Содержание
- 2. «Органическая химия может сейчас кого угодно свести с ума. Она представляется мне дремучим лесом, полным удивительных
- 3. Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) В состав органических веществ входят радикалы; Радикалы
- 4. Теория типов (40-50 гг. XIX в. Ш.Жерар, А.Кекуле и др.) Все органические вещества – производные простейших
- 5. К первой половине XIX века в органической химии был накоплен громадный фактический материал, дальнейшее изучение которого
- 6. Предпосылки возникновения теории Развитие и утверждение атомистических представлений (съезд в Карслруэ, 1860г.); Установление понятий валентности (Э.
- 7. Теоретические разработки добутлеровского периода внесли определенный вклад в познание строения органических соединений. Но ни одна из
- 8. Бутлеров Александр Михайлович (1828-1886) Русский химик, академик Петербургской АН (с 1874 г.). Окончил Казанский университет (1849
- 9. Теория строения органических соединений Теория химического строения органических соединений, выдвинутая А. М. Бутлеровым во второй половине
- 10. Основные положения теории строения органических веществ (А.М. Бутлеров 1861 – 1864 гг.) 1. Атомы в молекулах
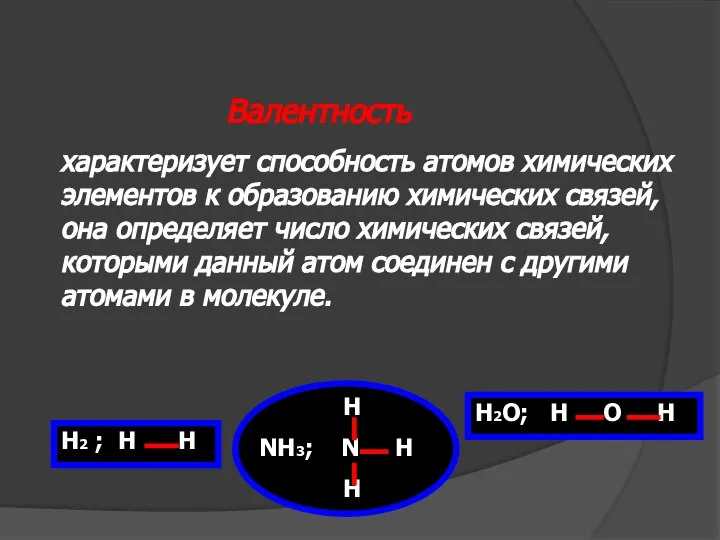
- 11. Валентность характеризует способность атомов химических элементов к образованию химических связей, она определяет число химических связей, которыми
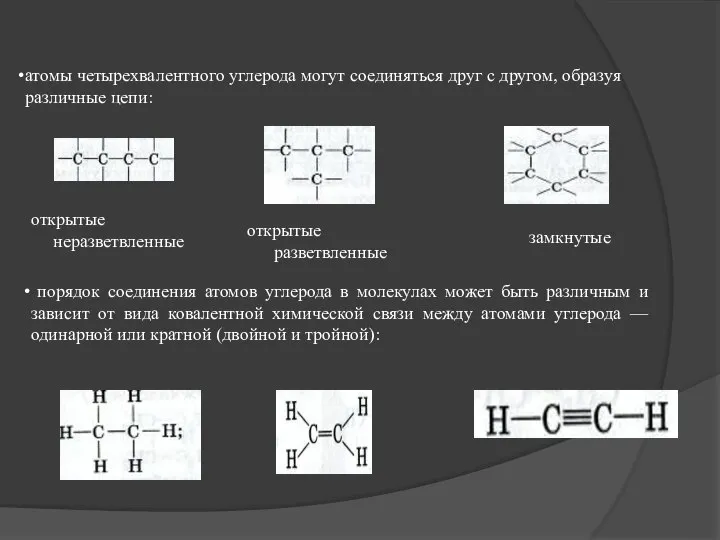
- 12. атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные цепи: открытые неразветвленные замкнутые порядок соединения
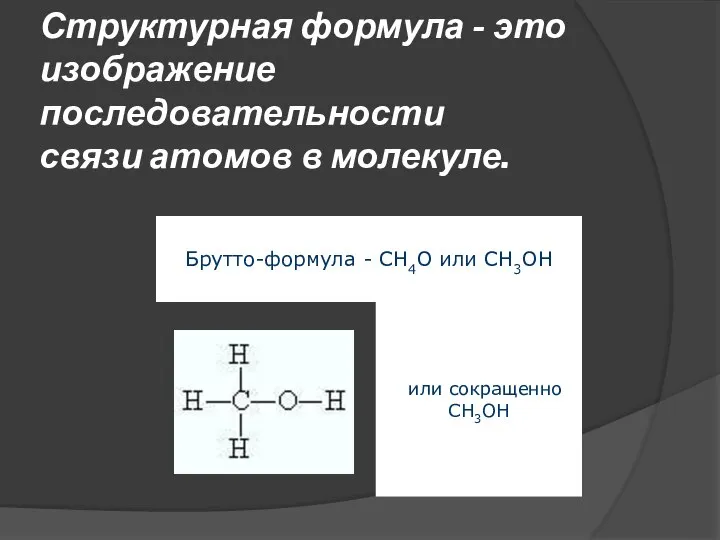
- 13. Структурная формула - это изображение последовательности связи атомов в молекуле.
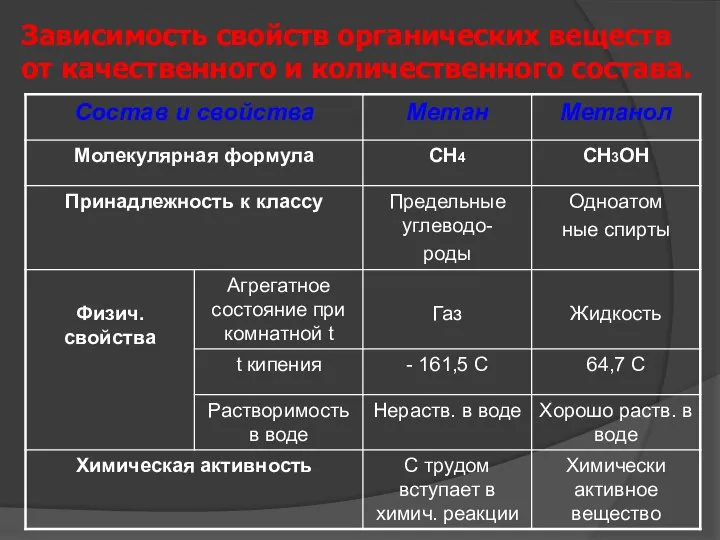
- 14. 2. Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов
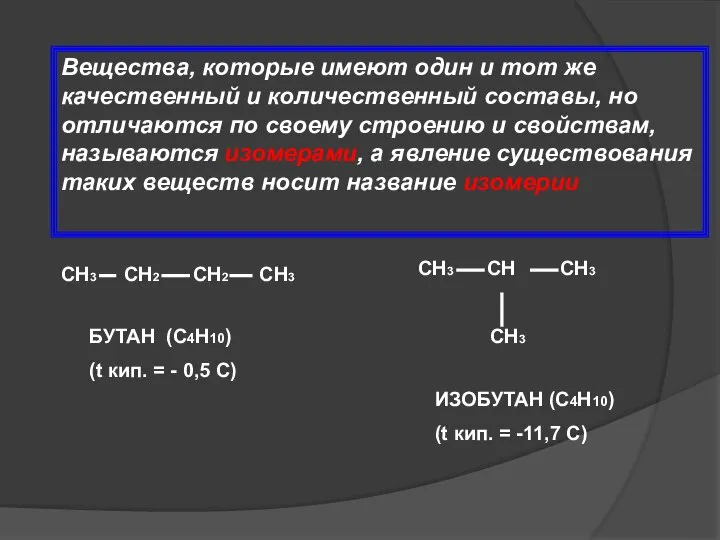
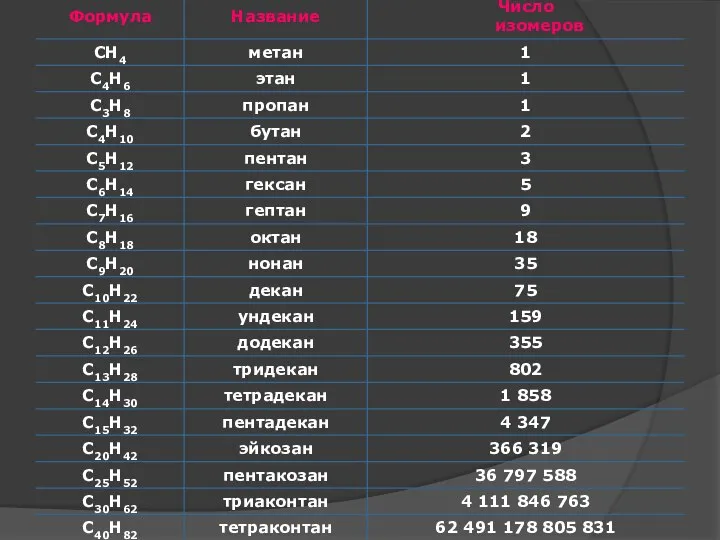
- 15. Вещества, которые имеют один и тот же качественный и количественный составы, но отличаются по своему строению
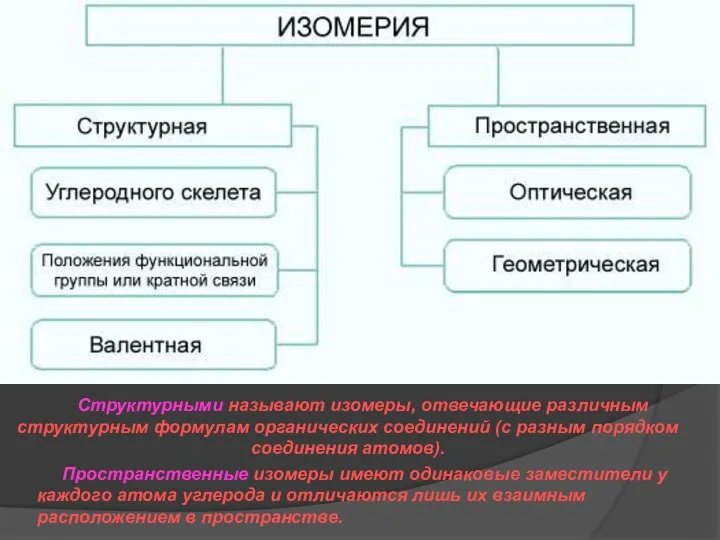
- 17. Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов). Пространственные изомеры
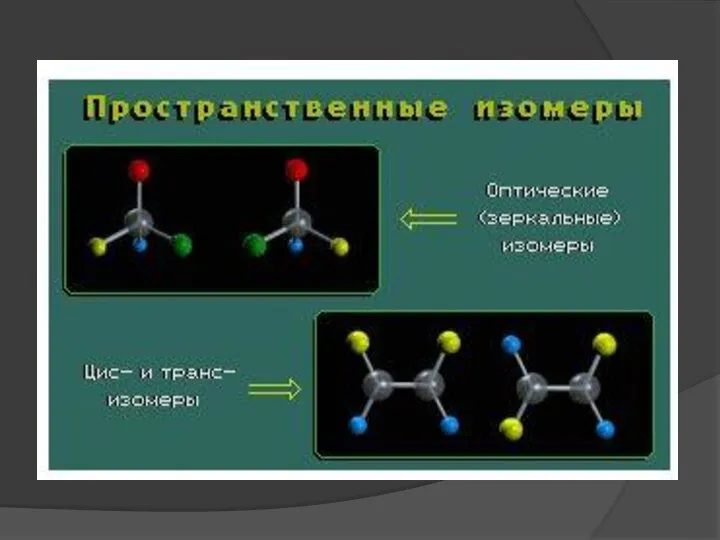
- 18. Пространственные изомеры (стереоизомеры). Стереоизомеры можно разделить на два типа: геометрические изомеры и оптические изомеры. Геометрическая изомерия
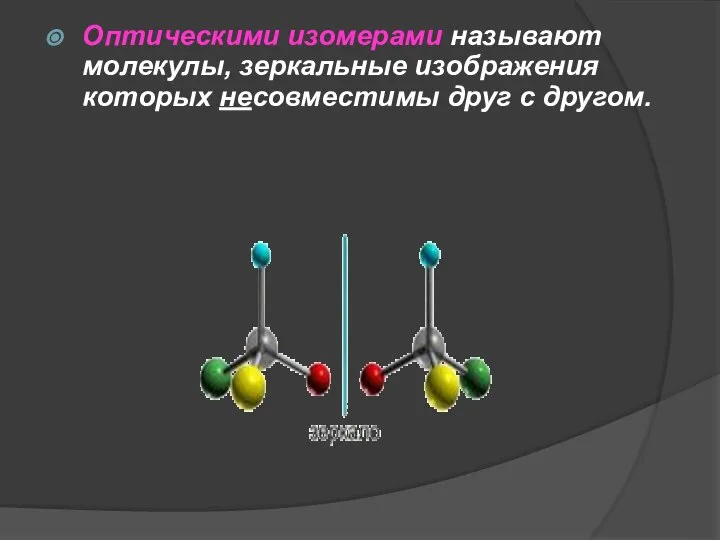
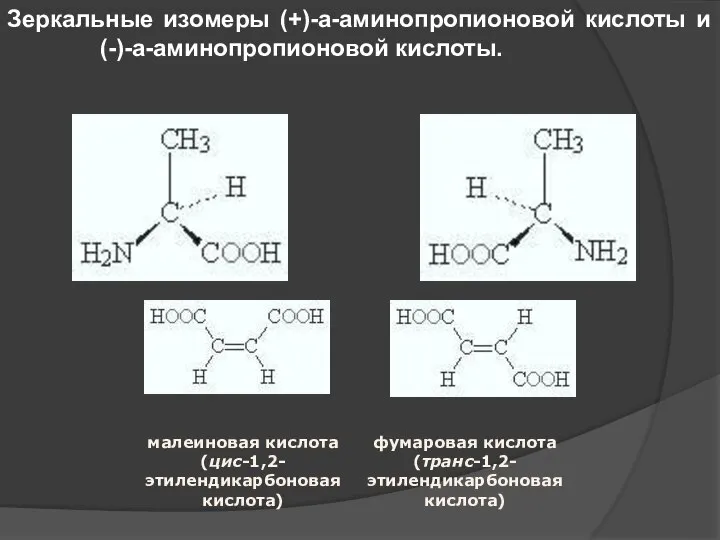
- 19. Оптическими изомерами называют молекулы, зеркальные изображения которых несовместимы друг с другом.
- 22. Зеркальные изомеры (+)-a-аминопропионовой кислоты и (-)-a-аминопропионовой кислоты.
- 23. Итак, изомерия – одно из наиболее своеобразных проявлений специфики и особенности органической химии.
- 24. 3. Свойства органических соединений зависят от взаимного влияния атомов и групп атомов в молекуле друг на
- 25. Зависимость свойств органических веществ от качественного и количественного состава.
- 27. Скачать презентацию














 Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Валентность. Что же это такое?
Валентность. Что же это такое? Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Масляная кислота
Масляная кислота Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Решение турнира. 9 класс
Решение турнира. 9 класс Коферменты. Промышленное получение и применение ферментов
Коферменты. Промышленное получение и применение ферментов Смазывающие вещества
Смазывающие вещества Сравнение активностей металлов
Сравнение активностей металлов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Карбоновые кислоты
Карбоновые кислоты Неорганические вещества в быту
Неорганические вещества в быту Ионо-дисперсное состояние микрокомпонентов в растворах
Ионо-дисперсное состояние микрокомпонентов в растворах Химия. Ребусы
Химия. Ребусы Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи
Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Термопласты: основные представители, сравнение свойств и область их применения
Термопласты: основные представители, сравнение свойств и область их применения Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Презентация на тему Степень окисления 8 класс
Презентация на тему Степень окисления 8 класс  Связь между основными классами неорганических соединений
Связь между основными классами неорганических соединений Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Алкины
Алкины Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Электрохимические процессы
Электрохимические процессы Витамины и их роль в жизни людей
Витамины и их роль в жизни людей