Слайд 3 В процессе электролиза после подачи тока от анода начинают идти фиолетовые

разводы, затем появляется устойчивое лёгкое фиолетовое окрашивание. Через некоторое время окраска уже тёмно-фиолетовая в случае разделения анодного и катодного пространства. При этом в катодном пространстве можно наблюдать выделение пузырьков газа.
Слайд 4Анодный процесс: Fe0 + 8 OH- - 6e- = FeO42- + 4H2O
Катодный

процесс: 2H+ + 2 e- = H2↑
Суммарно реакция выглядит так: Fe0+2NaOH+2H2O→Na2FeO4+2H2
Слайд 5полученный щелочной раствор феррата натрия не подлежит длительному хранению и должен использоваться

в течение четырех часов после приготовления.
Слайд 6
Так как ферраты являются антисептиками, они разлагают органические вещества ,поэтому их

используют при очистке питьевой воды.
Ферраты (VI) являются одними из наиболее мощных известных окислителей . Они способны разлагать многие токсичные химические вещества, а также вызывать гибель микроорганизмов (дезинфицирующее действие).
Слайд 7Продуктом разложения самих ферратов в растворе является гидроксид железа, то есть малотоксичный

продукт.
Проблема очистки воды электрохимическим методом получения феррат-ионами является комплексной, и для успешного выбора условий очистки необходимо решить ряд проблем.
Большие проблемы при электрохимической генерации феррат-ионов доставляет пассивация анода в щелочной среде.
Слайд 8При анодном растворении железа имеет место следующая реакция образования феррат-ионов:
Fe + 8OH- -

6e- → FeO42- + 4H2O
Слайд 9
при анодной поляризации железа в щелочной среде имеет место образование кислорода по

электрохимической реакции:
4ОН- - 4e- → 2Н2О + О2 (2)
Образовавшиеся феррат-ионы, к тому же, склонны к разложению в щелочной среде:
4FeO42- + 10H2O → 4Fe(OH)-4 + 4OH- + 3O2 (3)
Опытным путем установлено, что при продолжительности электролиза более 2-х часов более 90 % феррат ионов переходит в твердый осадок.
Слайд 10МЕТОДИКА
Калия феррат(VI) Формула: K2FeO4
Внешний вид:
Кристаллы темно фиолетового цвета, хорошо растворимые в воде

с последующим гидролизом.
Описание:
Калия феррат(VI) является сильным окислителем, способен воспламенить органические вещества. В воде хорошо растворим, однако очень быстро гидролизуется с образованием Fe(OH)3, KOH,O2.
Чтобы произвести кристаллизацию необходимо добавлять в раствор KOH до тех пор, пока ФК не начнет кристаллизоваться.
Слайд 11Необходимые реактивы:
H2O,KOH,Fe2O3, гипохлорит Натрия 5%(я использовала средство «Белизна»).
Необходимое оборудование:
Колба 500мл, Стакан химический

~600-800мл, спиртовка, жестяная банка, шпатель/ложечка средний металлический,
Стеклянная палочка, чаша (Петри)
Слайд 12Ход работы:
Необходимо смешать и размолоть в ступке KOH и Fe2O3, щелочи брать

в избытке. После размельчения, смесь пересыпается в жестянку и нагреть над спиртовкой.
Реакцию необходимо вести до тех пор, пока смесь не прекратит пузыриться и не образуется твердая корка.
Слайд 13В это время наливаю в хим. стакан «Белизну» примерно 350мл и добавляю

щелочь до 400 мл. Далее остывший продукт (KFeO2+KOH) необходимо измельчить (не сильно), для более быстрого растворения. И высыпать в раствор «Белизны» и КОН.
Необходимо тщательно перемешивать до растворения всех крупных частиц. Раствор будет окрашен в бурый коричневый цвет, и оставляю смесь на 30 минут в холодном месте до полного остывания.
Слайд 14Далее необходимо по капле добавлять КОН. До тех пор, пока смесь не

станет темно фиолетового цвета и не начнут образовываться кристаллы K2FeO4.
Слайд 15
Полученные кристаллы феррат-ионов можно отфильтровать ,используя этиловый спирт и вакуумный насос. В

дальнейшем можно применять для очистки воды














 Оксиды и основания
Оксиды и основания Строение атома
Строение атома Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Методология пробoотбора с использованием ТЧЭ
Методология пробoотбора с использованием ТЧЭ Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Дисперсные системы
Дисперсные системы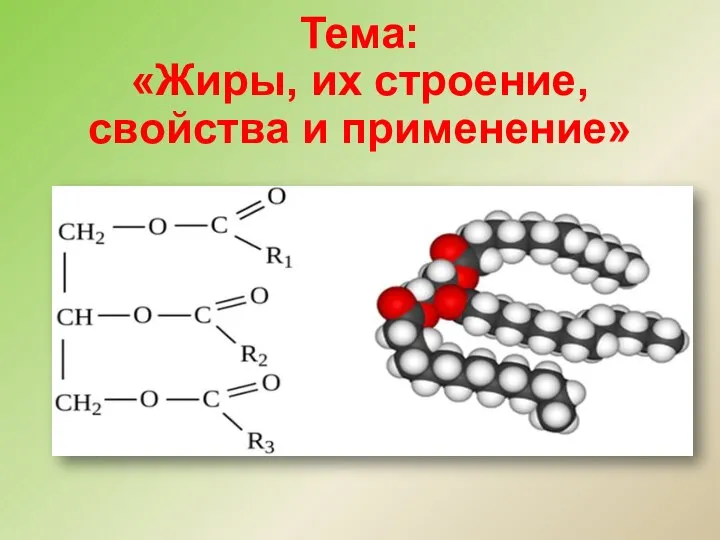 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Основы квантовой химии
Основы квантовой химии Теория гидродинамического подобия
Теория гидродинамического подобия Презентация на тему Менделеев Дмитрий Иванович
Презентация на тему Менделеев Дмитрий Иванович  Валентность
Валентность Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Алюминий
Алюминий Мономеры
Мономеры Окислительно-восстановительные реакции. Типы химических реакций
Окислительно-восстановительные реакции. Типы химических реакций Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Расстворение. Расстворы
Расстворение. Расстворы Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества
Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества Презентация на тему Амины
Презентация на тему Амины  Алкены
Алкены Производство аммиака
Производство аммиака Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Дисперсные системы в пищевой промышленности
Дисперсные системы в пищевой промышленности Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Основные положения МКТ
Основные положения МКТ Абсорбционная осушка газа
Абсорбционная осушка газа Углеводы. Несахароподобные полисахариды
Углеводы. Несахароподобные полисахариды