Содержание
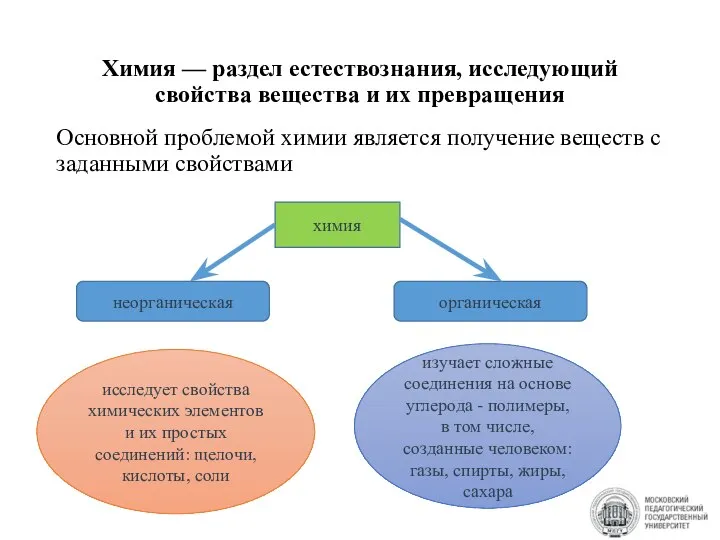
- 2. Химия — раздел естествознания, исследующий свойства вещества и их превращения Основной проблемой химии является получение веществ
- 3. Основные периоды развития химии Период алхимии - с древности до XVI в. нашей эры Главными задачами
- 4. 2. Период в течение XVI - XVIII веков Созданы теории Парацельса, теории газов Бойля, Кавендиша и
- 5. 3. Первые шестьдесят лет XIX века Характеризуется возникновением и развитием атомной теории Дальтона, атомно-молекулярной теории Авогадро
- 6. 4. С 60-х годов XIX века до наших дней Разработаны периодическая классификация элементов, теория ароматических соединений
- 7. Важнейшие особенности современной химии В химии появляются многочисленные самостоятельные научные дисциплины (химическая термодинамика, химическая кинетика, электрохимия,
- 8. В химии появляются принципиально новые методы исследования (рентгеновский структурный анализ, масс-спектроскопия, радиоспектроскопия и др.) Химия способствовала
- 9. В химии большинство химических соединений (96%) - это органические соединения. В их основе лежат 18 элементов
- 10. Концептуальные системы химии Понятие о химическом элементе Р. Бойль положил начало современному представлению о химическом элементе
- 11. Расположение химических элементов в порядке возрастания атомной массы привело к выявлению периодической зависимости: химические свойства повторяются
- 12. В связи с открытиями в ядерной физике, стало известно, что валентность отражает количество электронов на последней
- 13. Концепция химических соединений В начале XIX в. Ж. Пруст сформулировал закон постоянства состава, в соответствии с
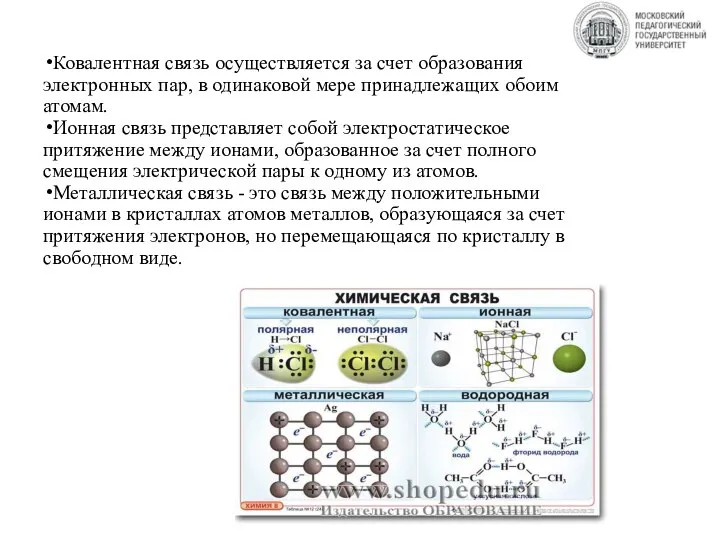
- 14. Ковалентная связь осуществляется за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам. Ионная связь
- 15. Учение о химических процессах В основе учения находятся химическая термодинамика и кинетика. Основоположник этого направления стал
- 16. Катализ(1812 г) - ускорение химической реакции в присутствии особых веществ - катализаторов, которые взаимодействуют с реагентами,
- 17. Антропогенный химизм и его влияние на среду обитания Задача органического синтеза – создание веществ со специфическими
- 18. Биоэтанол – это возобновляемый вид топлива. Этанол может добываться различными способами. Например, из зерновых культур: кукурузы,
- 19. Прикладная химия предлагает новые материалы, которые способны заменить металлы, хлопок, лен, шелк, дерево. Французы нашли способ
- 21. Скачать презентацию
















 карбоновые кислоты
карбоновые кислоты Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Стехиометрические законы химии
Стехиометрические законы химии 1_Лекція Комплексн
1_Лекція Комплексн Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Серная кислота
Серная кислота Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Диссоциация кислот, щелочей, солей
Диссоциация кислот, щелочей, солей Дисперсные системы
Дисперсные системы Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Биопластик на основе лигнина
Биопластик на основе лигнина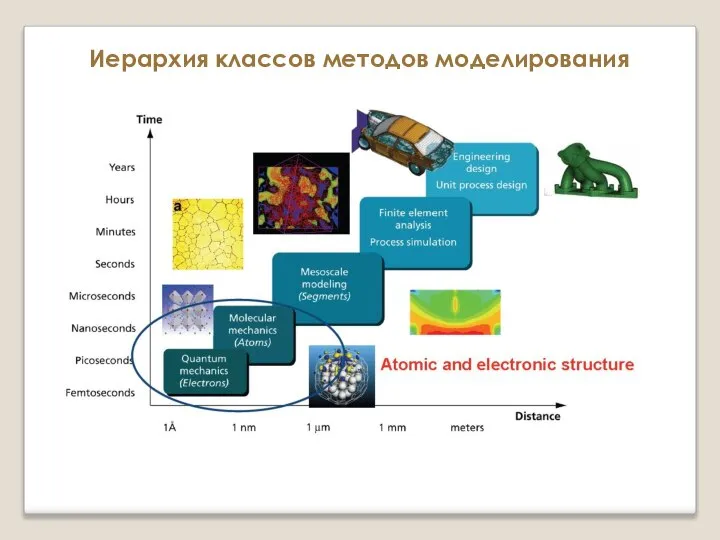 Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Вода и ее свойства
Вода и ее свойства Химическая связь
Химическая связь Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Камень, скользящий на льду
Камень, скользящий на льду Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алканы. Циклоалканы
Алканы. Циклоалканы Расчётно-графическая работа по теме Мыловарение
Расчётно-графическая работа по теме Мыловарение Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Химия в профессии ювелира
Химия в профессии ювелира Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Органическая химия и пищевые добавки
Органическая химия и пищевые добавки Обсидиан
Обсидиан Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс