Содержание
- 2. Цели урока Сформировать понятия о кристаллическом и аморфном состоянии твердых тел Дать представления о типах кристаллических
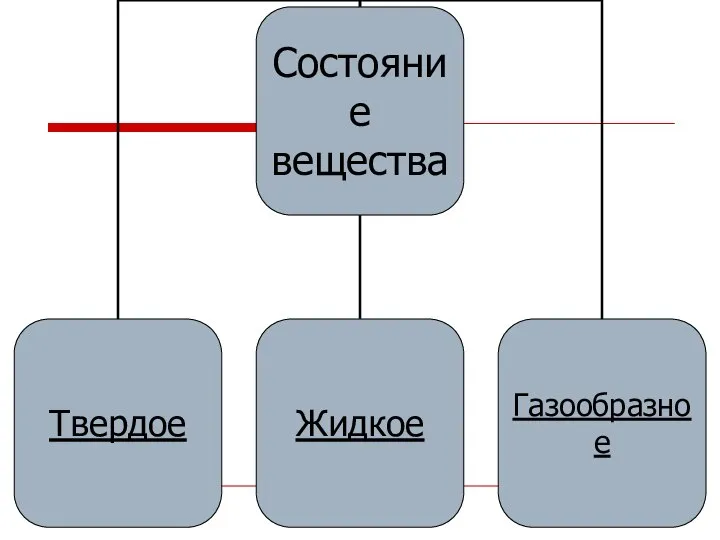
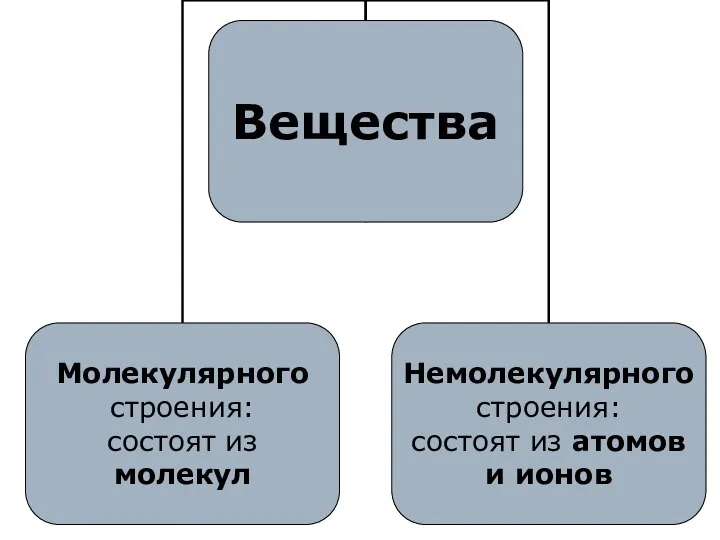
- 3. Вещество – то, из чего состоит физическое тело.
- 5. Аморфные вещества
- 6. Кристаллические вещества
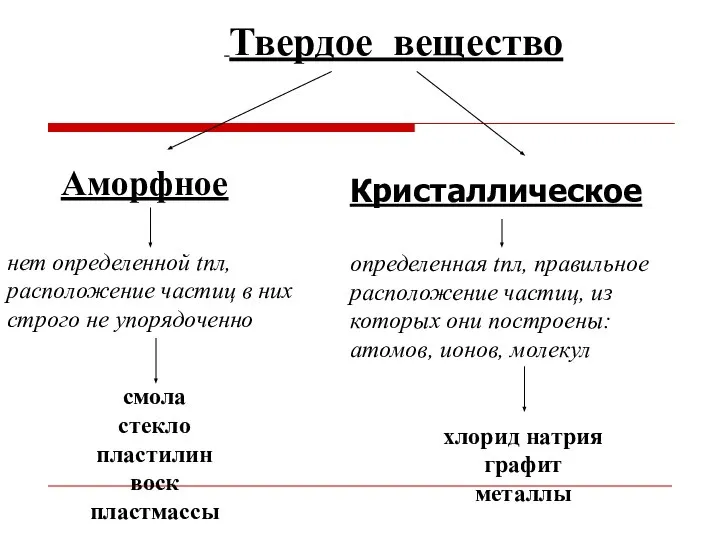
- 7. Твердое вещество Аморфное нет определенной tпл, расположение частиц в них строго не упорядоченно смола стекло пластилин
- 8. Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения
- 9. Вывод: Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие
- 10. Вывод: Строение атома ЭО Вид химической связи Тип кристаллической решетки Свойства веществ
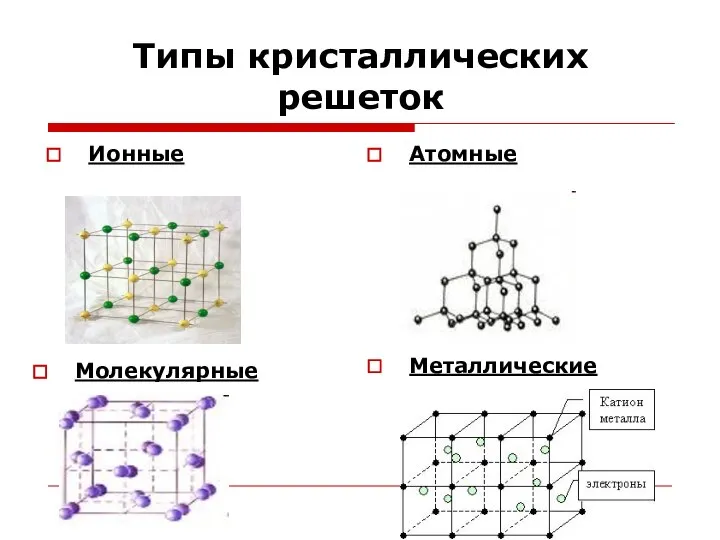
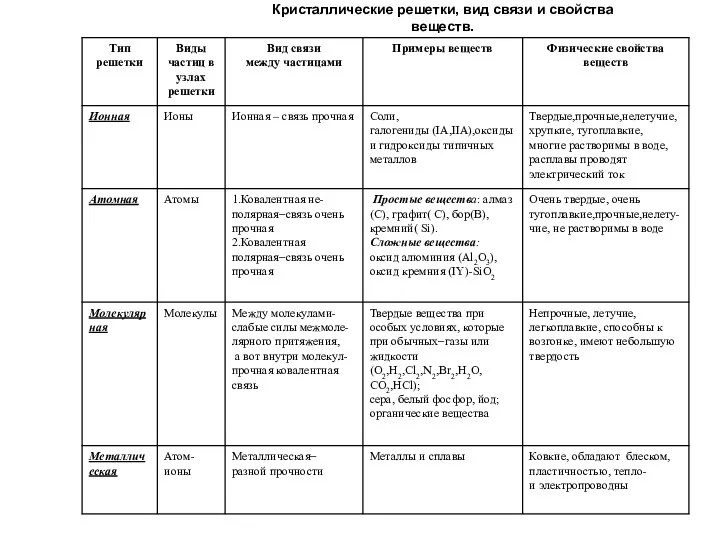
- 11. Типы кристаллических решеток Ионные Атомные Молекулярные Металлические
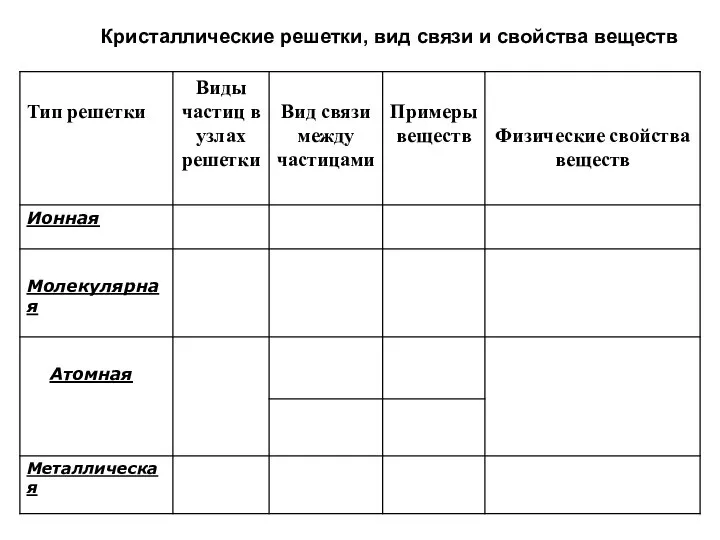
- 12. Кристаллические решетки, вид связи и свойства веществ
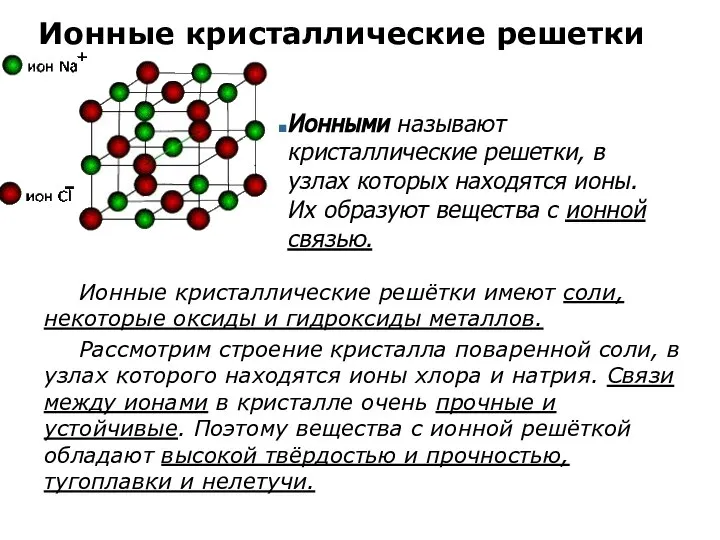
- 13. Ионные кристаллические решетки Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла
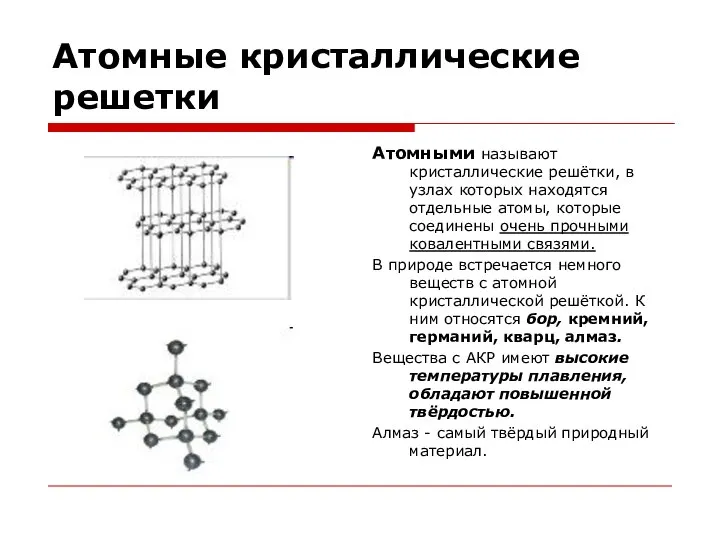
- 14. Атомные кристаллические решетки Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень
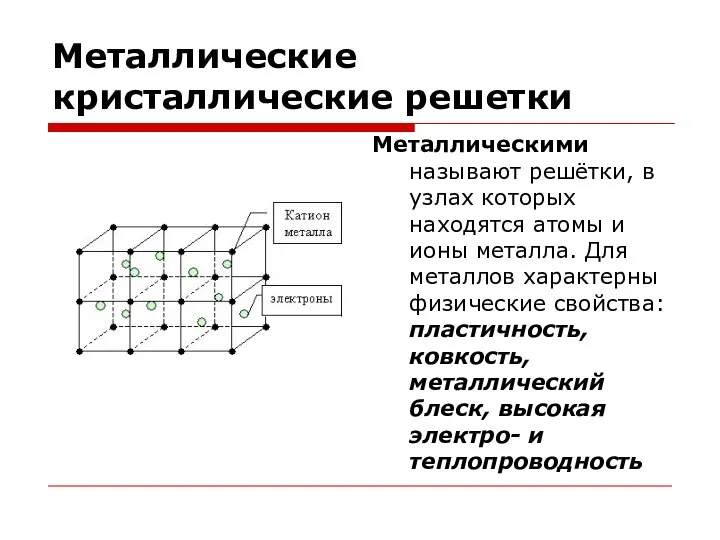
- 15. Металлические кристаллические решетки Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов
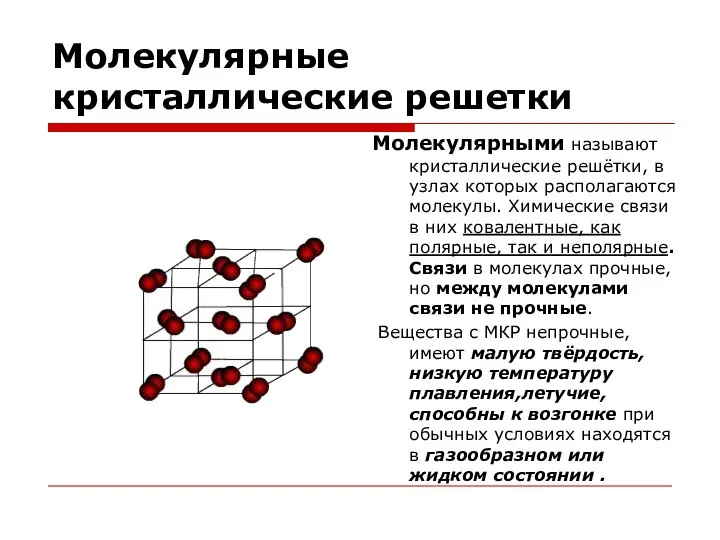
- 16. Молекулярные кристаллические решетки Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них
- 17. Кристаллические решетки, вид связи и свойства веществ.
- 18. Вывод: Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, или наоборот: если
- 20. Закон постоянства состава Жозеф Луи Пруст. 1808 г. родился 26 сентября 1754 г. в небольшом городке
- 21. Вывод: химическая формула вещества заключает в себе большую информацию SO3: 1.Конкретное вещество− серный газ, или оксид
- 22. Зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку.
- 25. Скачать презентацию











 Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Кислоты. Классификация кислот
Кислоты. Классификация кислот Основы химической термодинамики
Основы химической термодинамики Викторина Что это?
Викторина Что это? Типы химических реакций. Реакции разложения, реакции соединения.8 класс
Типы химических реакций. Реакции разложения, реакции соединения.8 класс Пластификация пластмасс
Пластификация пластмасс Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Молекулы. Свойства молекул
Молекулы. Свойства молекул Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Ионные уравнения
Ионные уравнения Современные химические топливные элементы
Современные химические топливные элементы Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Ренгеноструктурный и рентгеноспектральный анализы
Ренгеноструктурный и рентгеноспектральный анализы Алкины. Пропин
Алкины. Пропин Электролитическая диссоциация
Электролитическая диссоциация Химические реакции
Химические реакции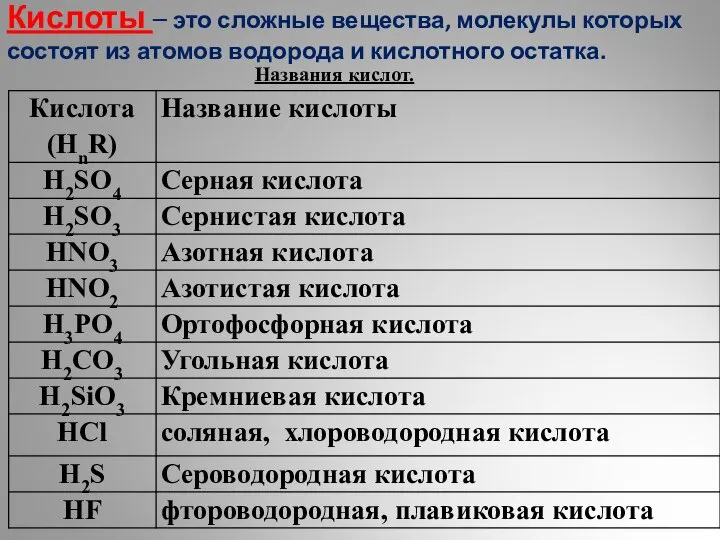 Кислоты. Классификация
Кислоты. Классификация Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Общая характеристика металлов
Общая характеристика металлов Разминка для болельщиков
Разминка для болельщиков Строение электронных оболочек
Строение электронных оболочек Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот