Содержание
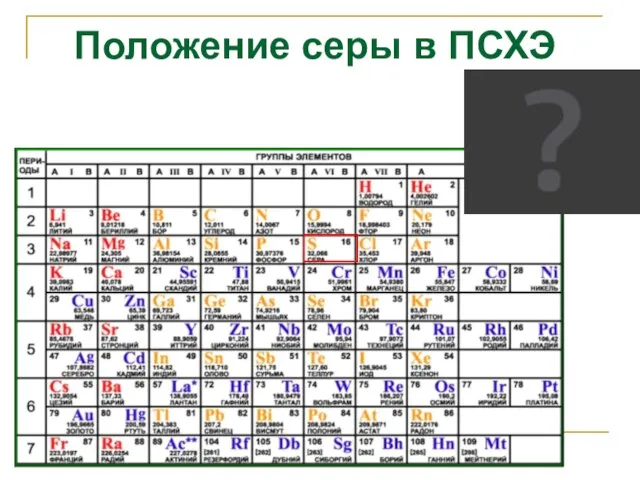
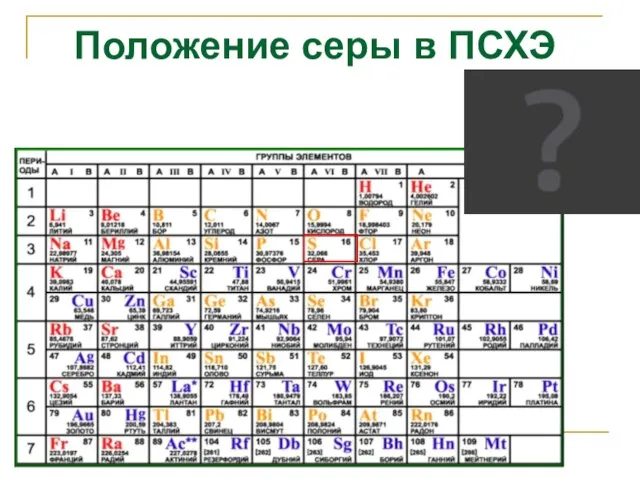
- 2. Положение серы в ПСХЭ
- 3. Положение серы в ПСХЭ
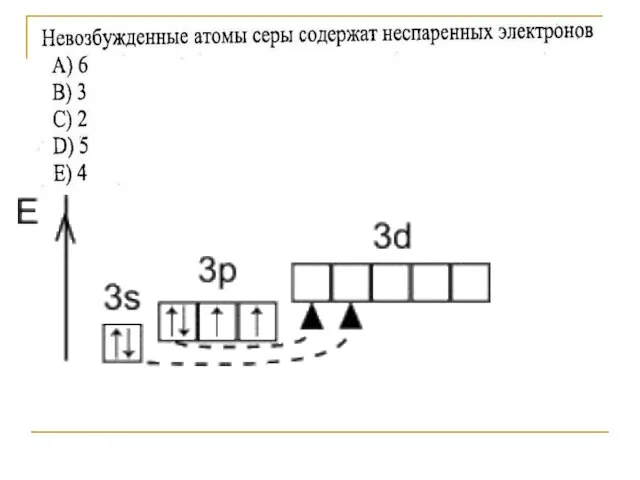
- 4. Строение атома серы
- 5. Окислительно-восстановительные свойства S-2 ⇄ S0 ⇄ S+4 ⇄ S+6 S-2 → только восстановители S0 → окислители,
- 6. Сера в природе
- 7. Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS (Балхаш
- 8. Физические свойства серы Агрегатное состояние ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ Цвет ЖЕЛТЫЙ Запах БЕЗ ЗАПАХА Растворимость в воде НЕ
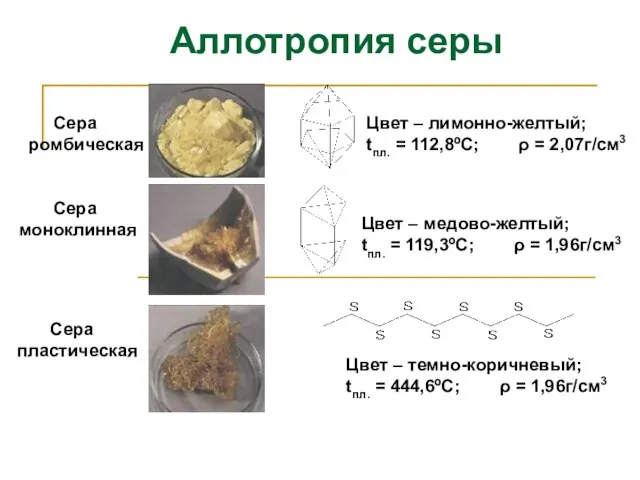
- 9. Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3 Цвет
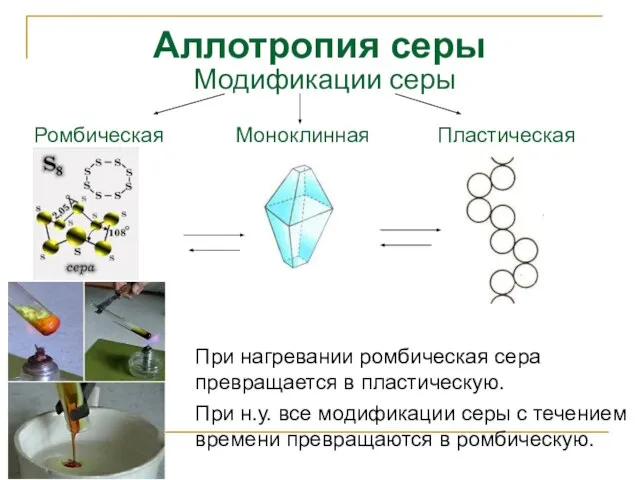
- 10. Аллотропия серы При нагревании ромбическая сера превращается в пластическую. При н.у. все модификации серы с течением
- 11. Реагирует с неметаллами (искл. азот N2 и иод I2): S + O2 = SO2 оксид серы
- 12. Реагирует с металлами (искл. золото Аu, платина Рt): 2Na + S = Na2S – сульфид натрия
- 13. Реагирует со сложными веществами: S + 2H2SO4(конц.) = 3SO2 + 2H2O S + 6HNO3(конц) = H2SO4
- 14. Получение серы 1. Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2) 2.
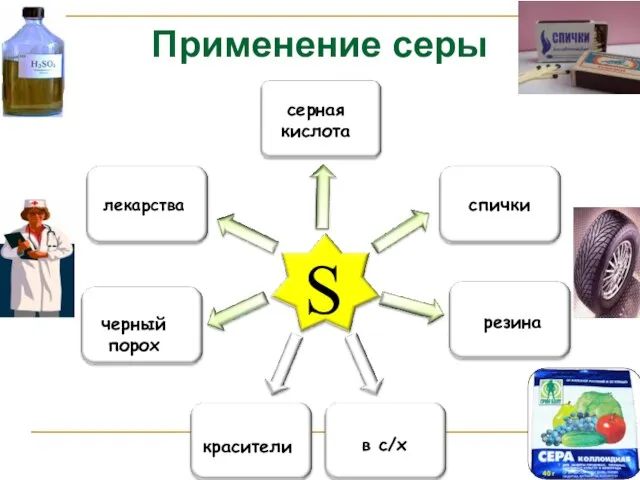
- 15. Применение серы
- 16. Сероводород Бесцветный газ с запахом тухлых яиц, тяжелее воздуха, яд Получение 1) H2 + S →
- 17. Взаимодействие H2S с водой Раствор H2S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация происходит
- 18. . H2S + Ме, основные оксиды, основания: H2S + 2NaOH изб. → Na2S + 2H2O H2S
- 19. Многие сульфиды окрашены (используется в аналитической химии)
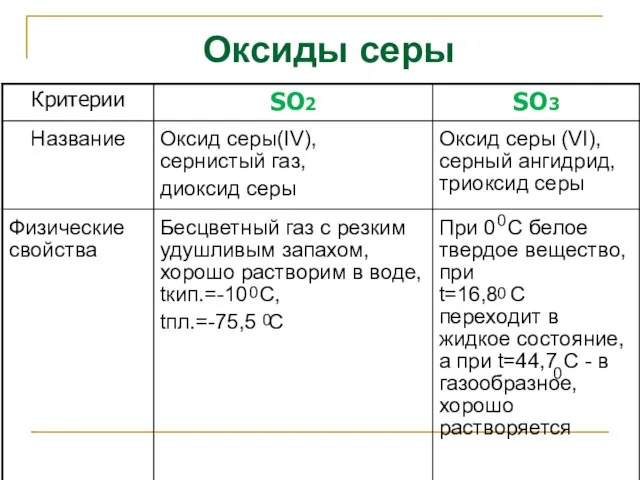
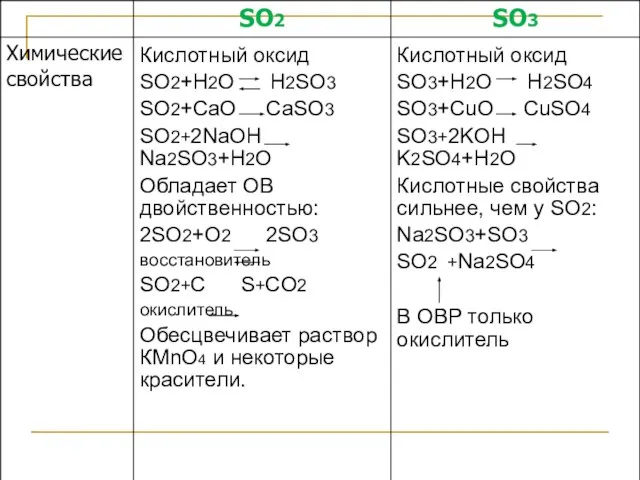
- 20. Оксиды серы 0 0 0 0 0
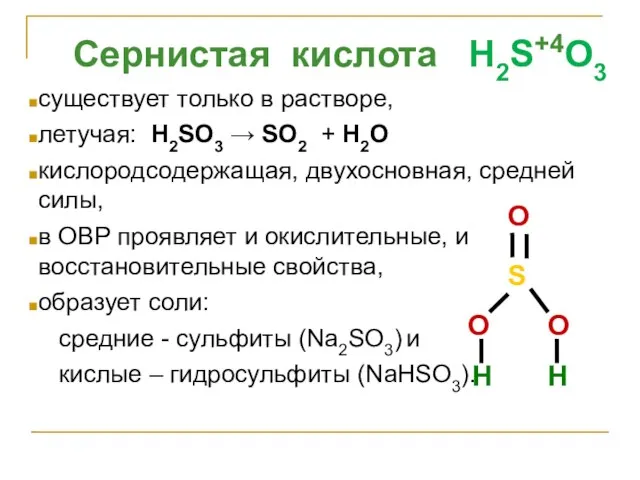
- 22. Сернистая кислота H2S+4O3 существует только в растворе, летучая: H2SO3 → SO2 + H2O кислородсодержащая, двухосновная, средней
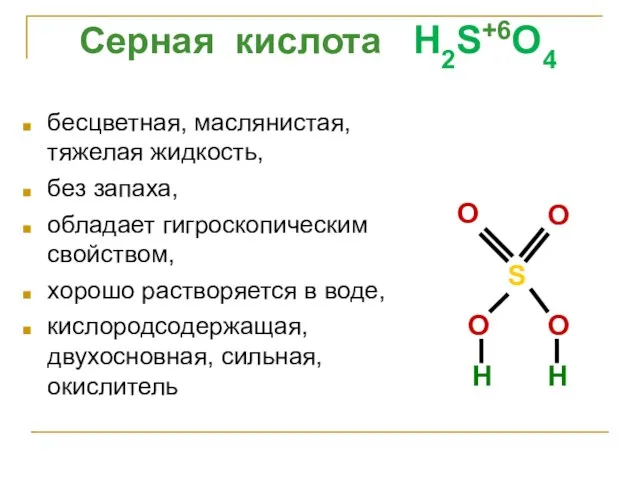
- 23. бесцветная, маслянистая, тяжелая жидкость, без запаха, обладает гигроскопическим свойством, хорошо растворяется в воде, кислородсодержащая, двухосновная, сильная,
- 24. S, H2S, FeS2 → SO2 → SO3 → H2SO4 1-я стадия. Печь для обжига колчедана. Получение
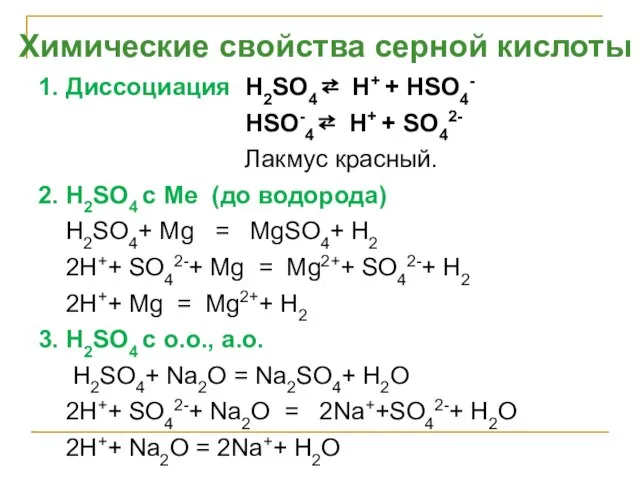
- 25. 1. Диссоциация H2SO4 ⇄ H+ + НSO4- HSO-4 ⇄ H+ + SO42- Лакмус красный. 2. H2SO4
- 26. 4. H2SO4 с основаниями H2SO4+2NaOH = Na2 SO4+ 2H2O 2H+ + SO42-+ 2Na+ + 2OH- =2Na++SO42-+
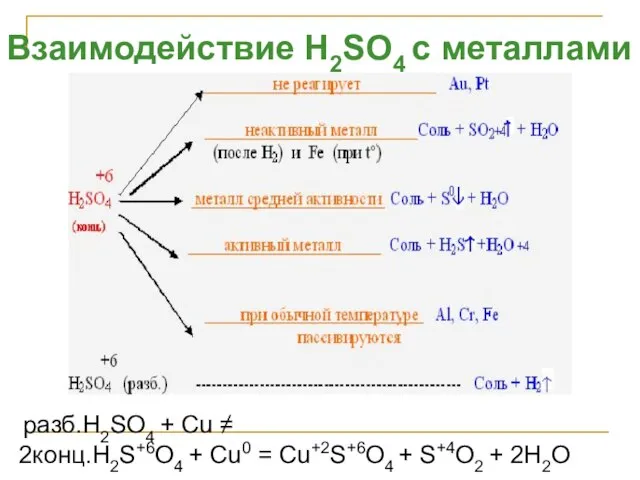
- 27. Взаимодействие H2SO4 с металлами разб.H2SO4 + Cu ≠ 2конц.H2S+6O4 + Cu0 = Cu+2S+6O4 + S+4O2 +
- 28. C12H22O11(сахароза)+H2SO4 →12С(уголь) +H2SO4 *11H2O Органические вещества обугливаются !!! C + 2H2SO4 = CO2 + 2SO2 +
- 29. Применение серной кислоты - в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в
- 31. Сумма всех электронов (SO3)= 16+8*3= 40 Сумма всех электронов (Н2SO4)= 1*2+16+8*4= 50
- 33. S+ Ме S+ НеМе S в воде не растворяется, не смачивается
- 34. S-2 → только восстановители S0 → окислители, восстановители S+4 → окислители, восстановители S+6 → только окислители
- 36. H2SO4 ⇄ H+ + НSO4- гидросульфат-ион HSO-4 ⇄ H+ + SO42- сульфат-ион Соли: гидросульфаты, сульфаты.
- 37. Са(ОН)2 ⇄ СаОН+ + ОН- 2Са(ОН)2 + Н2SО4 = (СаОН)2SО4 + 2Н2О 2 + 1+ 1
- 38. Серная кислота реагирует с металлами (до Н), основными и амфотерными оксидами, основаниями. Ответ: А.
- 39. 2H2SO4 + Cu = CuSO4 + SO2 + 2H2O Сумма коэффициентов 2 + 1 + 1
- 41. Обжиг пирита 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
- 42. гипс CaSO4∙2H2O
- 43. Н2S → SО2 → SО3 → Н2SО4 → SО2
- 47. Скачать презентацию
































 Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Полезные ископаемые
Полезные ископаемые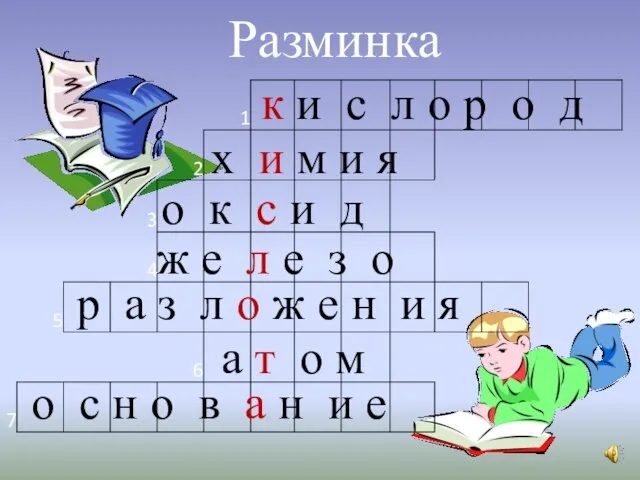 Разминка
Разминка Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Предельные углеводороды - алканы
Предельные углеводороды - алканы Химия в быту
Химия в быту Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Углеводороды (УВ)
Углеводороды (УВ) Магматические горные породы
Магматические горные породы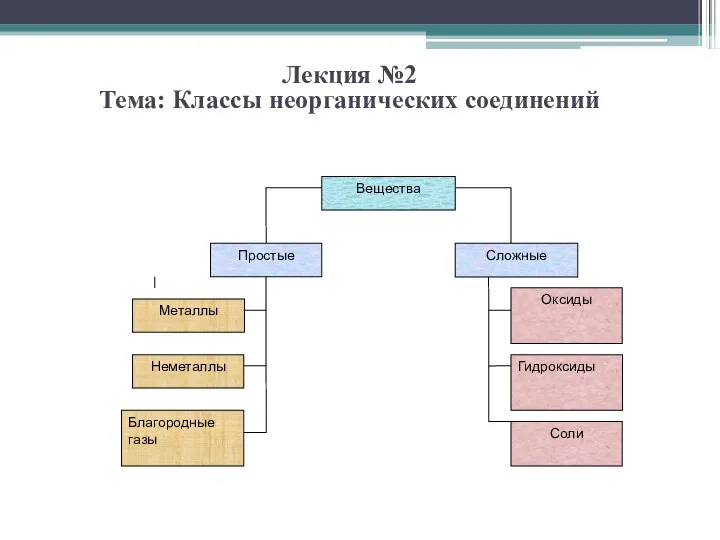 Лекция 2 Классы неорганических соединений (1)
Лекция 2 Классы неорганических соединений (1) Соли
Соли Алканы
Алканы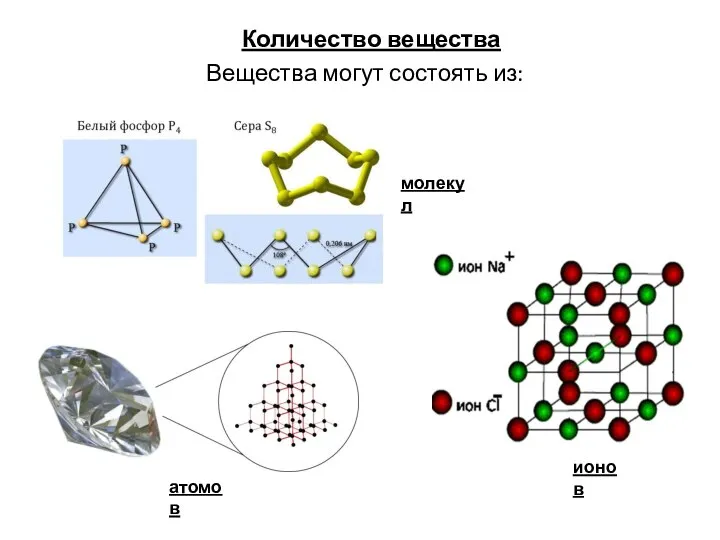 Количество вещества
Количество вещества Кислоты в химии
Кислоты в химии Атом
Атом Хімія в стоматології
Хімія в стоматології Моделирование состава биоплёночного материала
Моделирование состава биоплёночного материала Электролит
Электролит Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Cложные реакции. Лекция 3
Cложные реакции. Лекция 3 Природные источники углеводородов
Природные источники углеводородов Экстракция и кристаллизация
Экстракция и кристаллизация Металлы. Общие свойства
Металлы. Общие свойства Классификация органических веществ
Классификация органических веществ Амины. Аминокислоты
Амины. Аминокислоты Химическая кинетика
Химическая кинетика Соль - без вины виновата
Соль - без вины виновата