Слайд 3АМФОТЕРНОСТЬ
способность некоторых соединений проявлять в зависимости от условий как кислотные, так и

основные свойства.
1814 г. Ж. Гей-Люссак, Л. Тенар.
Амфотерные - оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в зависимости от условий
Слайд 5они взаимодействуют с
кислотами и щелочами.
https://youtu.be/7rJj3WTk9Vw
Изучаем химию: Амфотерность

Слайд 6КИСЛОТНЫЕ СВОЙСТВА
Амфотерные соединения взаимодействуя с основаниями, ведут себя как кислоты.
2KOH(тв.) + H2ZnO2(тв.) = K2ZnO2 + 2H2O
2KOH(тв.) + Zn(OH)2(тв.) =

K2ZnO2 + 2H2O
Слайд 8http://himija8en.blogspot.ru/p/blog-page_23.html
Be(OH)2(тв.) +2NaOH(тв.) =Na2BeO2 + 2H2O
(метабериллат натрия, или бериллат)
Pb(OH)2(тв.) +2NaOH(тв.) = Na2PbO2 + 2H2O
(метаплюмбат натрия, или плюмбат)
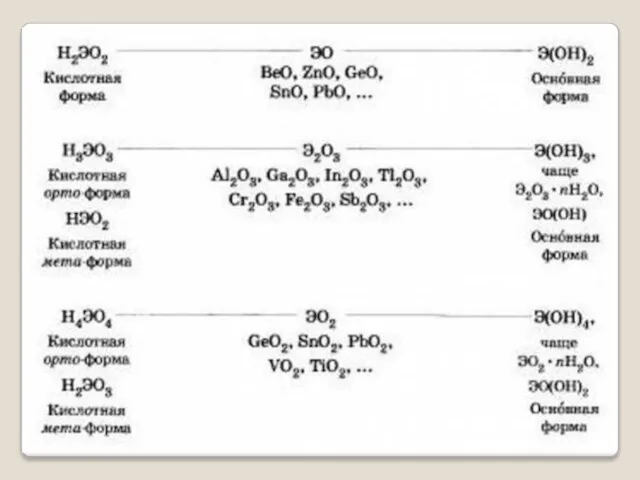
Al(OH)3, запишем в виде кислоты: H3AlO3,

выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или алюминат)
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2 (метаалюминат калия)
Слайд 9образуются комплексные соединения:
Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С растворами щелочей реагируют и амфотерные оксиды.
![образуются комплексные соединения: Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия); Al(OH)3 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/894129/slide-8.jpg)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей и являются растворимыми.
[Al(OH)4]- или [Al(OH)6]3-
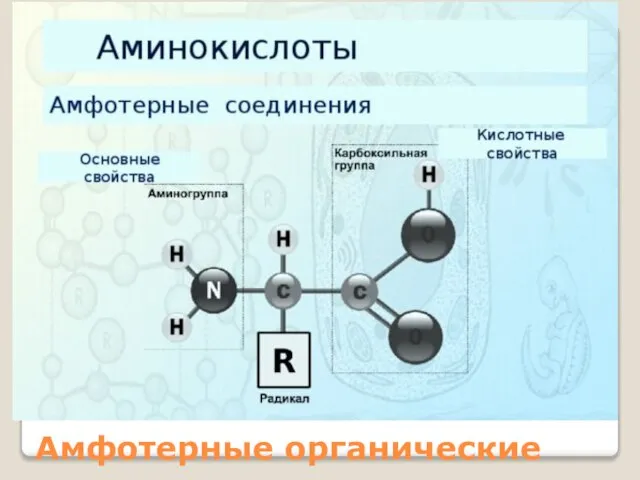
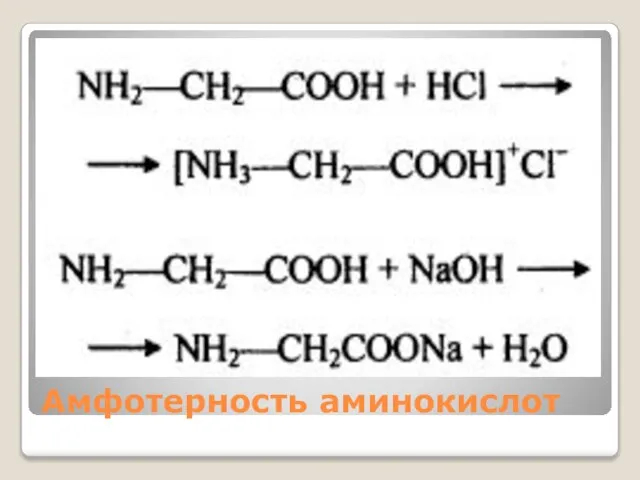
Слайд 11Цвиттер-ион (биполярный ион— гибрид) — электронейтральная молекула, которая в своей структуре имеет
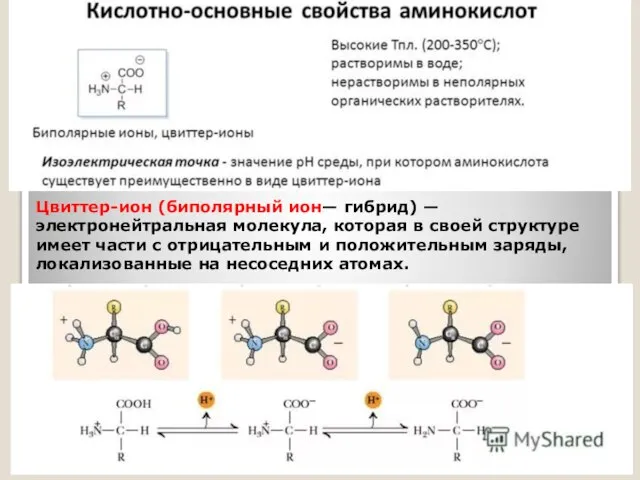
части с отрицательным и положительным заряды, локализованные на несоседних атомах.
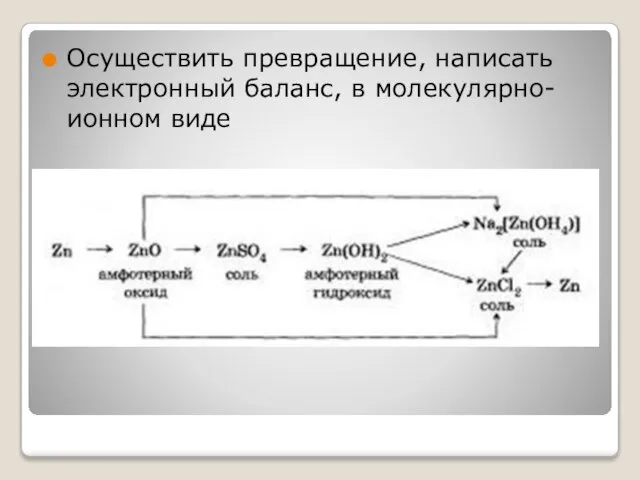
Слайд 13Осуществить превращение, написать электронный баланс, в молекулярно-ионном виде
Слайд 14Al → А12O3 →AlCl3 → Al(OH)3 → NaAlO2







![образуются комплексные соединения: Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия); Al(OH)3 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/894129/slide-8.jpg)



 Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Химические реакции
Химические реакции Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Соли, их классификация и свойства
Соли, их классификация и свойства Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Звездный час. Знатоки химии
Звездный час. Знатоки химии Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Кристаллы и минералы
Кристаллы и минералы Первые химические символы
Первые химические символы Кондуктометрический анализ
Кондуктометрический анализ Металлы. Определения
Металлы. Определения Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Полипропилен (ПП)
Полипропилен (ПП) Карбоновые кислоты
Карбоновые кислоты Галогеноводородные кислоты
Галогеноводородные кислоты Химические реакции в органике
Химические реакции в органике Химия природная и синтетическая: за и против
Химия природная и синтетическая: за и против Дзержинский политехнический институт. Отчет о работе химической школы
Дзержинский политехнический институт. Отчет о работе химической школы Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Сталь. Свойства стали
Сталь. Свойства стали Водород
Водород