Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства)
Содержание
- 3. Окислительно-восстановительные свойства NO: NO+O3=NO2+O2 NO+C=N2+CO2 NO2: 2NO2+O3=N2O5+O2 2NO2+7H2=2NH3+4H2O
- 4. Методы получения и химические свойства аммиака и его солей Получение аммиака: N2+3H2=2NH3 (450 C, 300 атм.,
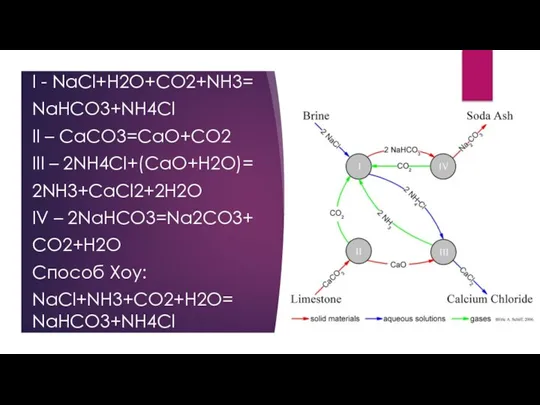
- 6. I - NaCl+H2O+CO2+NH3= NaHCO3+NH4Cl II – CaCO3=CaO+CO2 III – 2NH4Cl+(CaO+H2O)= 2NH3+CaCl2+2H2O IV – 2NaHCO3=Na2CO3+ CO2+H2O Способ
- 7. Химические свойства аммиака 2NH3+H2S=(NH4)2S (-40C) 4NH3+5O2=4NO+6H2O (800C, кат. Pt/Rh) 2NH3+Cl2=NH2Cl+NH4Cl (комн., в атм. N2) 8NH3+3Cl2=N2+6NH4Cl (сгорание)
- 8. Химические свойства солей аммиака 2NH4Cl+Ca(OH)2(тв.)=CaCl2+2NH3+2H2O (200С) (NH4)2CO3+2HCl(разб.)=2NH4Cl+H2O+CO2 NH4Cl=NH3+HCl (выше 338С) NH4НSO4=SO3+H2O+NH3 (выше 500С) NH4NO2=N2+2H2O (60-70С) NH4NO3=N2O+2H2O
- 9. При контакте серы и древесного угля с расплавленным нитратом калия происходит их возгорание. В чем горят
- 10. Энергетическая диаграмма по методу МО ЛКАО частицы N2+2, порядок связи.
- 12. Скачать презентацию








 Соли как производные кислот и оснований. Их состав и названия
Соли как производные кислот и оснований. Их состав и названия Предельные одноатомные спирты
Предельные одноатомные спирты Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Металлургия в химии
Металлургия в химии Химия дома
Химия дома Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения.
Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения. Сложные эфиры
Сложные эфиры Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Образование химических связей
Образование химических связей Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Фосфор в организме человека
Фосфор в организме человека Углерод. Характеристика элемента
Углерод. Характеристика элемента Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Производство чугуна и стали
Производство чугуна и стали Электролитическая диссоциация
Электролитическая диссоциация Ионные уравнения реакций
Ионные уравнения реакций Морфологогия минералов
Морфологогия минералов Презентация на тему Аминокислоты
Презентация на тему Аминокислоты  Многоатомные спирты
Многоатомные спирты Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Презентация на тему Производство серной кислоты
Презентация на тему Производство серной кислоты  Кислоты. Свойства кислот
Кислоты. Свойства кислот Теория растворов. (Тема 1.5)
Теория растворов. (Тема 1.5) Интерактивный плакат Алканы
Интерактивный плакат Алканы Алкины. Понятие об алкинах
Алкины. Понятие об алкинах