Содержание
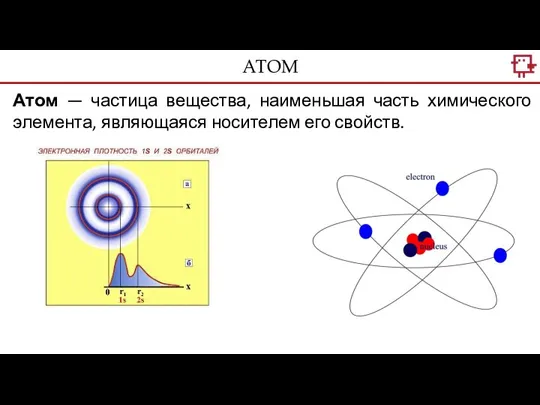
- 2. Атом — частица вещества, наименьшая часть химического элемента, являющаяся носителем его свойств. АТОМ
- 3. Одним из первых доказательств существования атомов, считается эксперимент ирландского химика Роберта Бойля. PV = const Воздух
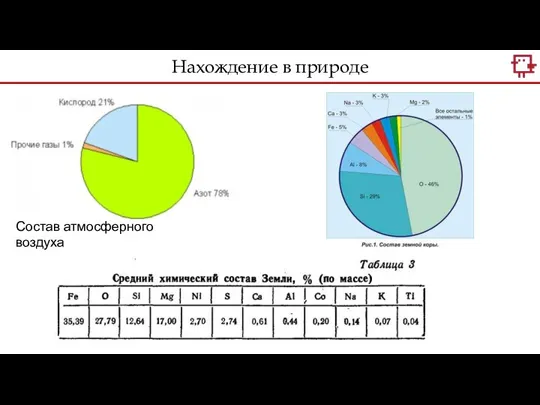
- 4. Нахождение в природе Состав атмосферного воздуха
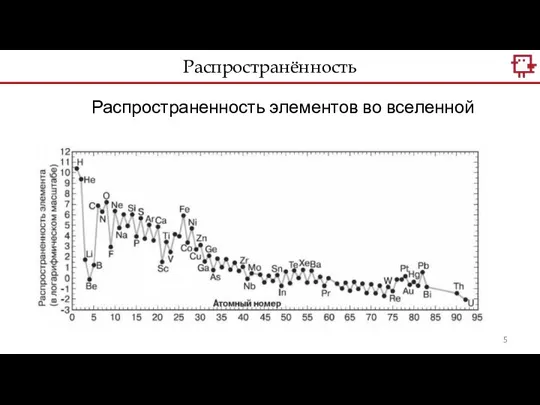
- 5. Распространённость Распространенность элементов во вселенной
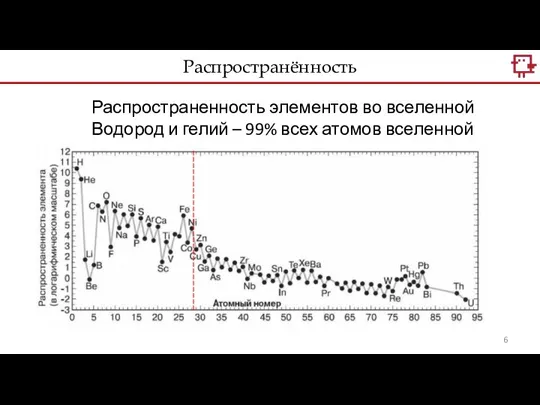
- 6. Распространённость Распространенность элементов во вселенной Водород и гелий – 99% всех атомов вселенной
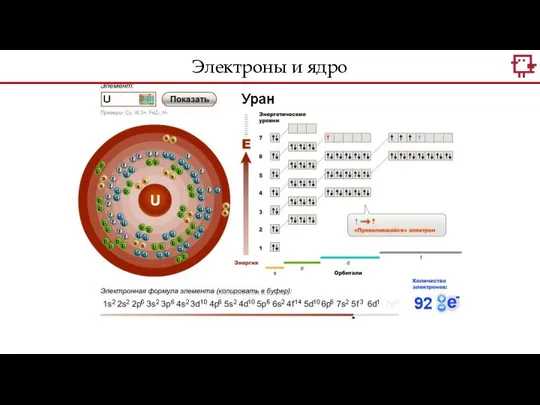
- 7. Электроны и ядро
- 8. А что здесь? Может ли что-то поменяться? Уран бывает 235 и 238? Электроны и ядро
- 9. В ядро атома входят нейтроны и протоны. Количество протонов отвечает за количество электронов и химический элемент.
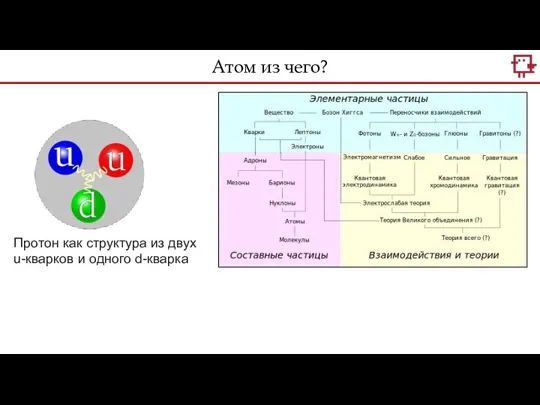
- 10. Атом из чего? Протон как структура из двух u-кварков и одного d-кварка
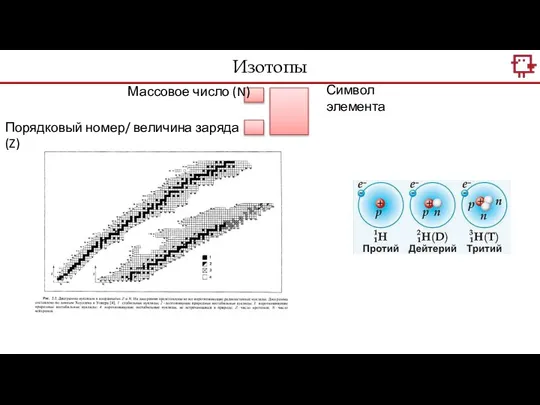
- 11. Символ элемента Массовое число (N) Порядковый номер/ величина заряда (Z) Изотопы
- 12. Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные
- 13. Тяжёлая вода – молекула воды, в которой вместо водорода дейтерий. Важнейшим свойством тяжёловодородной воды является то,
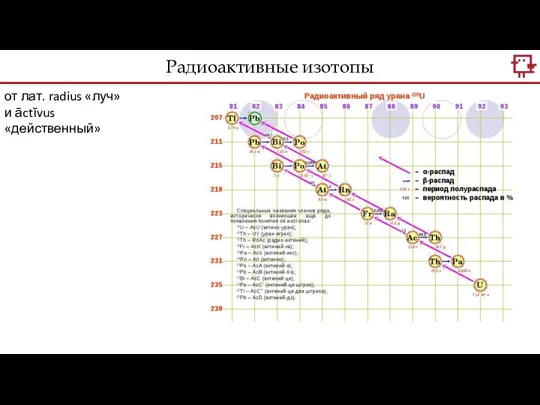
- 14. Радиоактивные изотопы от лат. radius «луч» и āctīvus «действенный»
- 15. Термоядерные реакции Температура ядра Основная ядерная реакция Формирующиеся элементы
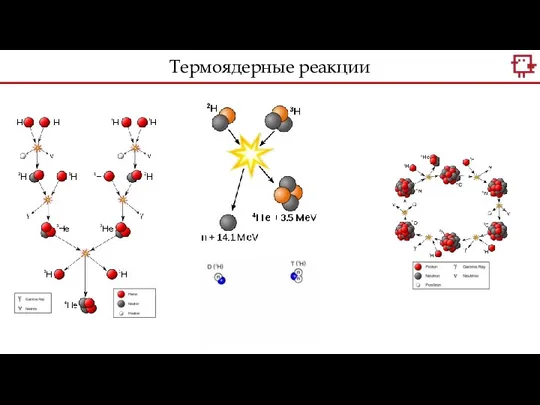
- 16. Термоядерные реакции
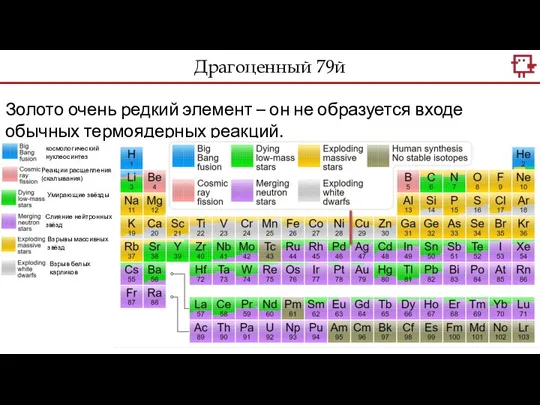
- 17. Драгоценный 79й Золото очень редкий элемент – он не образуется входе обычных термоядерных реакций. Реакции расщепления(скалывания)
- 19. Скачать презентацию






 Химическая викторина
Химическая викторина Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Каучук. История открытия каучука
Каучук. История открытия каучука Тепловые, массобменные и химические процессы
Тепловые, массобменные и химические процессы Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Образование химических связей
Образование химических связей Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Полимеры в медицине
Полимеры в медицине Презентация по Химии "Конструкции из стекла"
Презентация по Химии "Конструкции из стекла"  Путешествие в мир кислот
Путешествие в мир кислот Алканы
Алканы Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Природные источники углеводородов
Природные источники углеводородов Горный хрусталь
Горный хрусталь Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Предмет органической химии
Предмет органической химии Коллоидные системы
Коллоидные системы Арены. Бензол
Арены. Бензол Направление химических реакций
Направление химических реакций Медь и её сплавы
Медь и её сплавы Формула аспирина. Решение задач
Формула аспирина. Решение задач Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition
Dense Yttria Film Deposited on a Plasma-Sprayed Al2Oз Coating by Aerosol Deposition Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Метод Гиллеспи–Найхолма
Метод Гиллеспи–Найхолма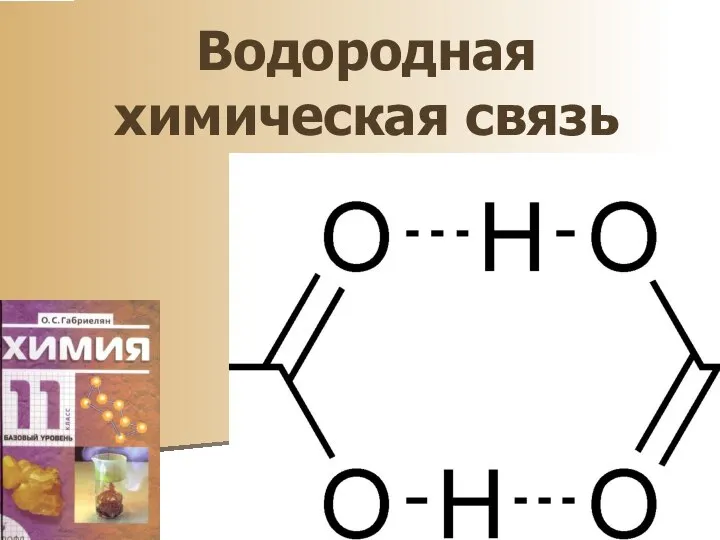 Водородная химическая связь
Водородная химическая связь Путешествие по городу химиков
Путешествие по городу химиков