Содержание
- 2. Характеристика курса:
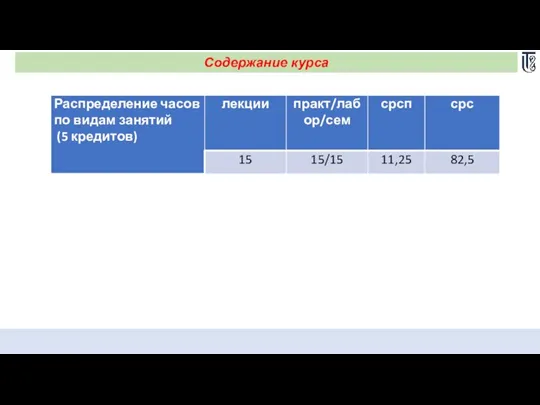
- 3. Содержание курса
- 4. Литература
- 5. Пререквизиты и постреквизиты
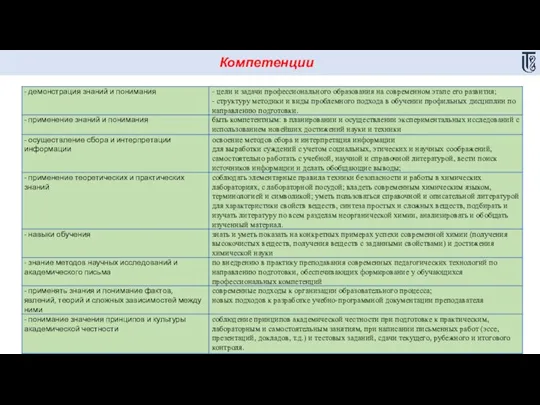
- 6. Компетенции
- 7. Академическая политика Академическая политика в НАО «Торайгыров университет» подразумевают обязательное соблюдение принципов Академической честности обучающимися, профессорско-преподавательским
- 8. Политика курса Посещение обучающимися всех очных аудиторных занятий без опозданий является обязательным. В случае пропуска занятия,
- 9. Политика курса Повторение темы и отработка пройденных материалов по каждому учебному занятию обязательны. Степень освоения учебных
- 10. Политика курса Обучающиеся должны посещать онлайн занятия, пропуски допускаются при уважительных причинах с условием обязательной отработки.
- 11. Лекция 1 Введение. Предмет изучения физической химии. Оралтаева Алмагуль Слямбековна [email protected]
- 12. План занятия Предмет физической химии. Основные разделы физической химии. Основные методы физической химии Основные агрегатные состояния
- 13. Что изучает физическая химия? Физическая химия изучает законы, управляющие химическими процессами, связь этих процессов со свойствами
- 14. Какие разделы включает Физическая химия ? 1). Строение вещества (раздел, в котором изучается взаимосвязь между строением
- 15. Основные методы физической химии 1) Квантово-механический метод (применяется к изучению структуры и свойств молекул, расчету химических
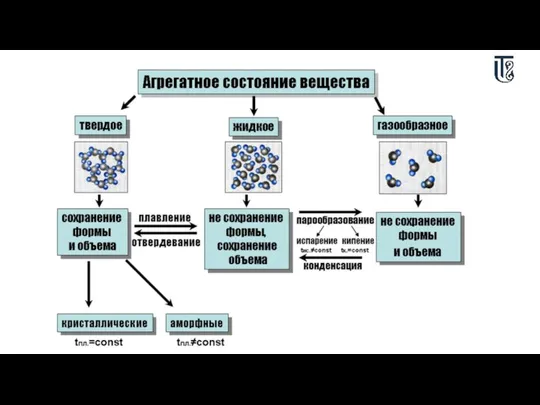
- 17. Основные агрегатные состояния веществ В зависимости от температуры и давления (условий) большинство веществ может находиться в
- 18. Строение твердых тел Молекулы твердых веществ образуют образуют твердую кристаллическую решетку. Расстояние межу молекулами очень малы
- 19. Строение жидкостей Молекулы жидкости расположены почти вплотную друг к другу , поэтому молекула жидкости ведет себя
- 20. Газообразные вещества В газах расстояние между атомами или молекулами в среднем во много раз больше размеров
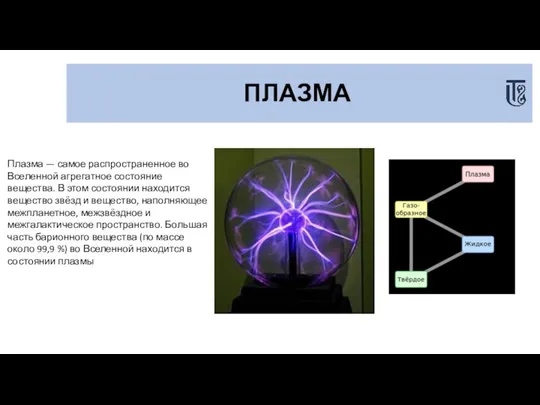
- 21. ПЛАЗМА Плазма — самое распространенное во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд
- 22. Газовые законы Физическое состояние газов определяется тремя переменными (параметрами): давление (Р), температура (Т), объем (V). При
- 23. Вопросы для самоконтроля 1. Что изучает физическая химия? Разделы физической химии. 2. Основные методы физической химии.
- 25. Скачать презентацию


















 Рівноваги у розчинах електролітів
Рівноваги у розчинах електролітів Основные классы неорганических веществ. Оксиды
Основные классы неорганических веществ. Оксиды Постулаты Онзагера
Постулаты Онзагера Золото. Золотые сплавы
Золото. Золотые сплавы Как осуществить цепочку превращений на основании положений теории электролитической диссоциации?
Как осуществить цепочку превращений на основании положений теории электролитической диссоциации? Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Классификация химических реакций
Классификация химических реакций Основания (Ме+n(ОН)-n)
Основания (Ме+n(ОН)-n) Химические вещества
Химические вещества Электролитическая диссоциация
Электролитическая диссоциация Коррозия металла
Коррозия металла Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Свойства воды
Свойства воды Алкены
Алкены Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов Водород
Водород Закон сохранения массы веществ
Закон сохранения массы веществ Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции
Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции Эпоксидті полимер материалдарының қасиеттерін зерттеу
Эпоксидті полимер материалдарының қасиеттерін зерттеу Физическое явление в химии
Физическое явление в химии Презентация на тему Соединения азота
Презентация на тему Соединения азота  Спирты
Спирты Термодинамика и теплопередача. Влажный воздух
Термодинамика и теплопередача. Влажный воздух Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Неорганические вещества
Неорганические вещества Что такое бинарные соединения?
Что такое бинарные соединения? Органическая химия. Введение
Органическая химия. Введение