Содержание
- 2. ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ 1. Метод валентных связей (ВС). 2. Теория кристаллического поля (ТКП). 3.
- 3. Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера
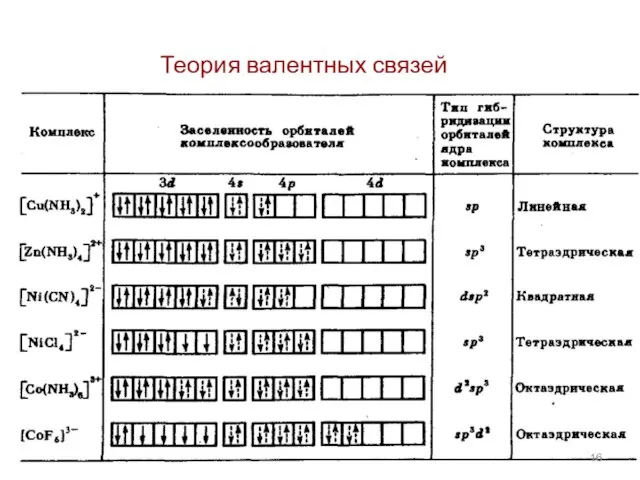
- 4. Теория валентных связей 1. Связь между комплексообразователем и лигандами является донорно-акцепторной. Лиганды предоставляют электронные пары, а
- 5. 2. Орбитали комплексообразователя подвергаются гибридизации. Тип гибридизации зависит от природы и электронной структурой центрального атома (Ц.А.).
- 6. 3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя: а) При наличии неспаренных электронов комплекс
- 7. 4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей. Типичные комплексообразователи - элементы, у которых
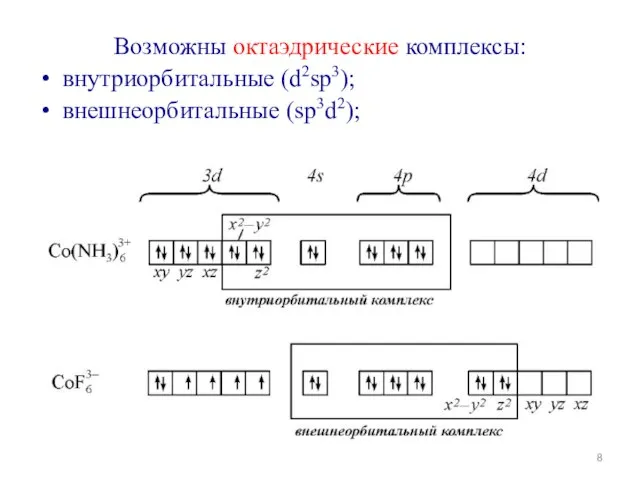
- 8. Возможны октаэдрические комплексы: внутриорбитальные (d2sp3); внешнеорбитальные (sp3d2);
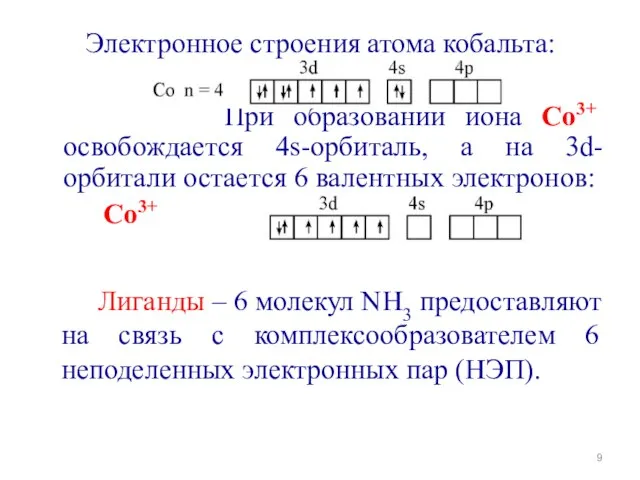
- 9. Электронное строения атома кобальта: При образовании иона Со3+ освобождается 4s-орбиталь, а на 3d-орбитали остается 6 валентных
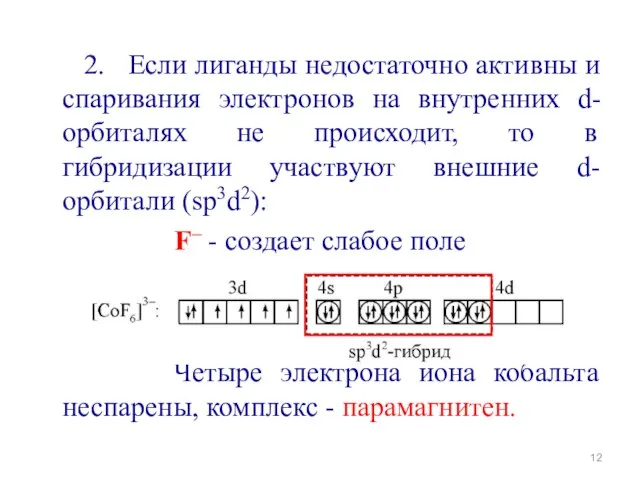
- 10. 1. Лиганды, создающие сильное поле, могут влиять на комплексообразователь. Электроны Ц.А. могут спариваться и освобождать две
- 11. Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.
- 12. 2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации
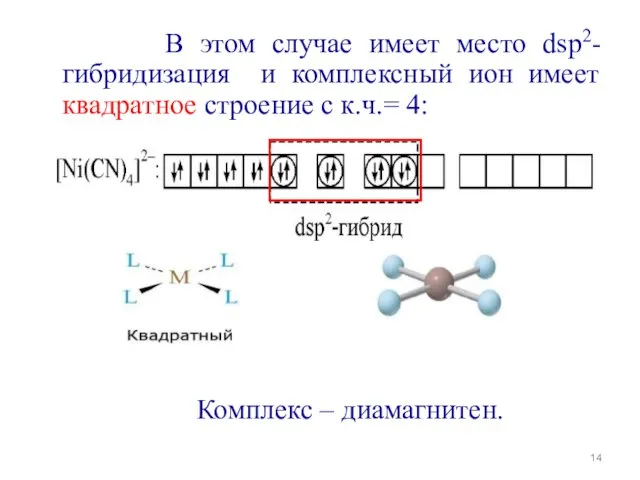
- 13. 3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку,
- 14. В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4: Комплекс
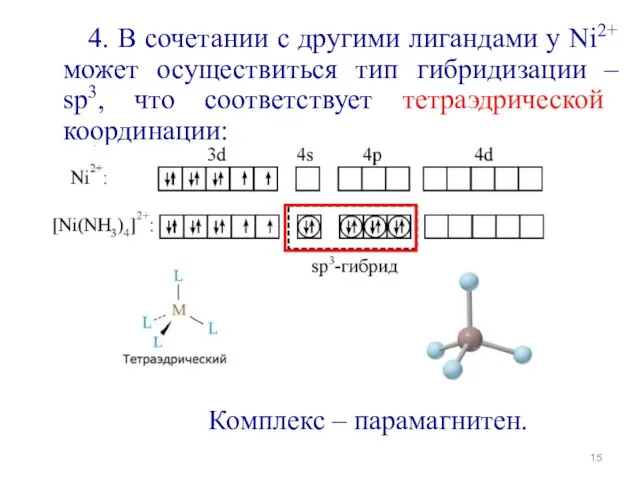
- 15. 4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует
- 16. Теория валентных связей
- 17. Недостатки метода ВС: Не объясняет и не предсказывает оптические свойства (цветность). Не объясняет силу лигандов, т.е.
- 18. 2. Теория кристаллического поля Химическая связь между комплек-сообразователем и лигандами ионная или иондипольная. Лиганды считаются точечными
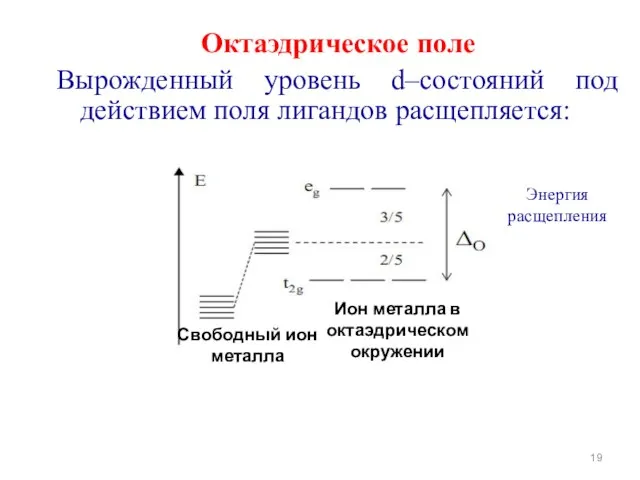
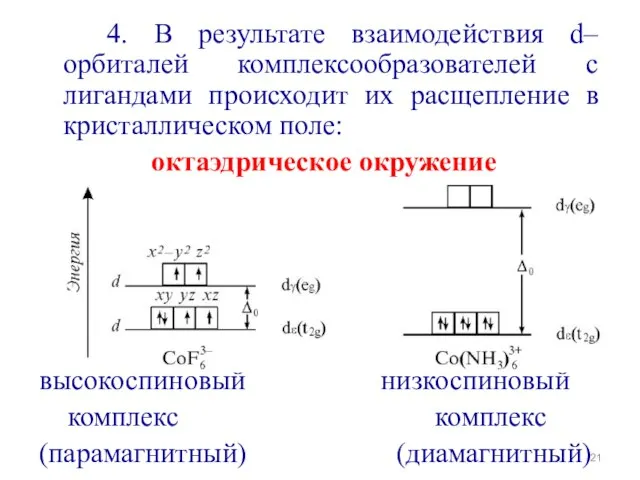
- 19. Октаэдрическое поле Вырожденный уровень d–состояний под действием поля лигандов расщепляется: Энергия расщепления Ион металла в октаэдрическом
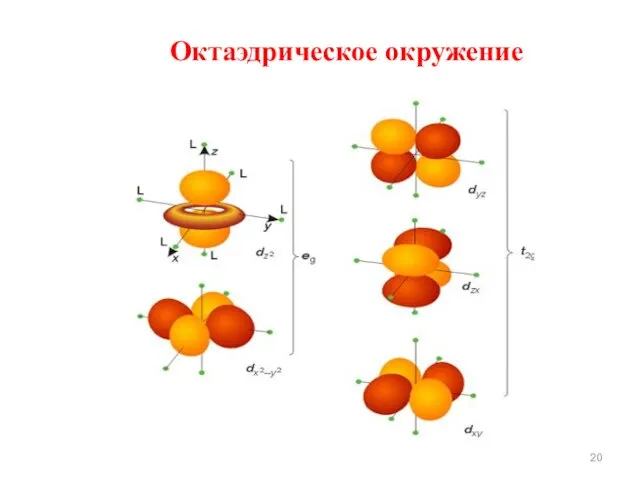
- 20. Октаэдрическое окружение
- 21. 4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле: октаэдрическое окружение
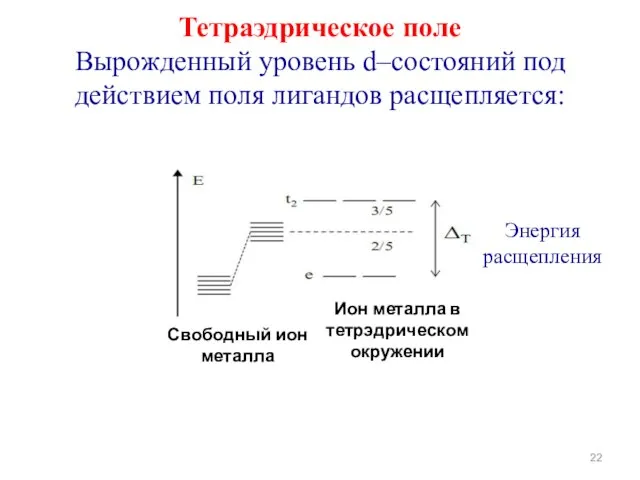
- 22. Тетраэдрическое поле Вырожденный уровень d–состояний под действием поля лигандов расщепляется: Энергия расщепления Ион металла в тетрэдрическом
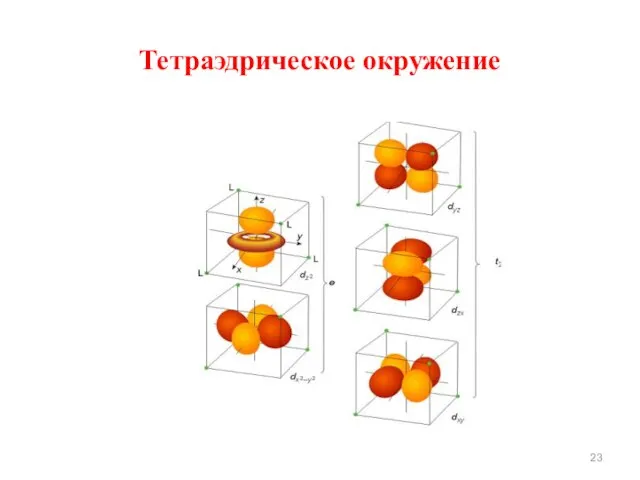
- 23. Тетраэдрическое окружение
- 24. 5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда. В спектрохимическом ряду лиганды расположены
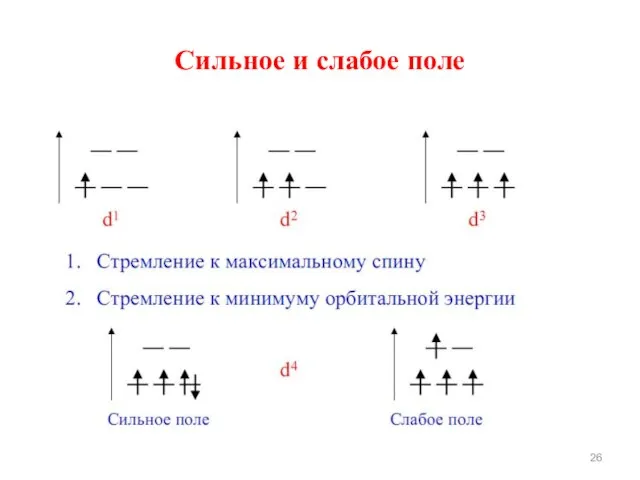
- 25. 6. Заполнение орбиталей происходит в соответствии с правилом Хунда: а) если имеются лиганды со слабым расщепляющим
- 26. Сильное и слабое поле
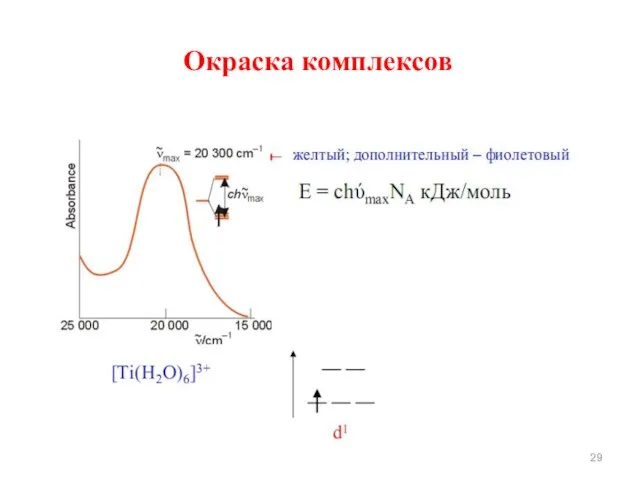
- 28. Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в
- 29. Окраска комплексов
- 30. Теория кристаллического поля
- 31. 3. Метод молекулярных орбиталей (Ван Флек, 30-40 гг. XX в). ● Образование комплекса и снятие вырождения
- 32. Строение октаэдрических комплексов с σ-связями металл-лиганд – [M(NH3)6]z+ Валентными орбиталями иона металла Mz+ являются (n-1)d-, ns-
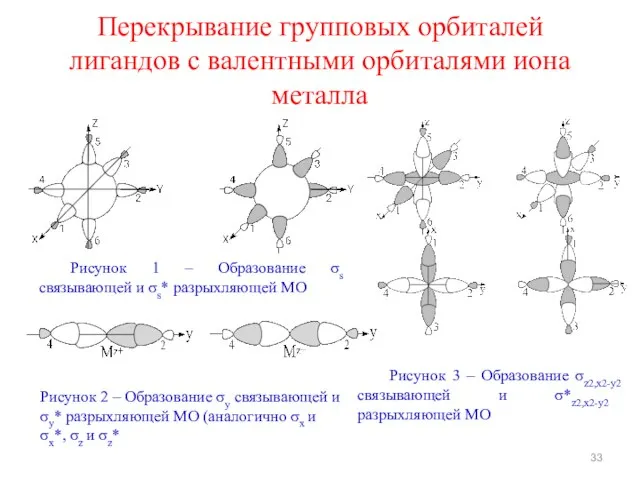
- 33. Перекрывание групповых орбиталей лигандов с валентными орбиталями иона металла Рисунок 1 – Образование σs связывающей и
- 34. Качественная диаграмма МО [M(NH3)6]z+ комплексов Электронная формула M(NH3)6]3+: (σs)2(σx,y,z)6(σx2-y2,z2)4(nxy,xz,yz)x (σ*x2-y2,z2)y (x+y=q)
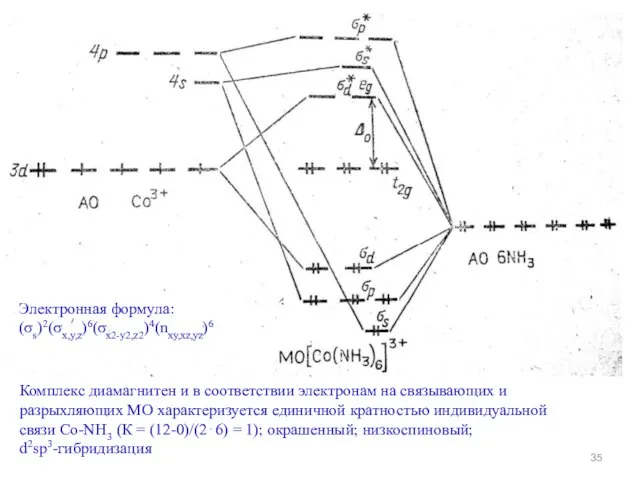
- 35. Электронная формула: (σs)2(σx,y,z)6(σx2-y2,z2)4(nxy,xz,yz)6 Комплекс диамагнитен и в соответствии электронам на связывающих и разрыхляющих МО характеризуется единичной
- 36. Электронное строение [M(NH3)6]z+ в рамках ТПЛ, ТКП, МВС МВС ТКП Шести электронным парам лигандов на связывающих
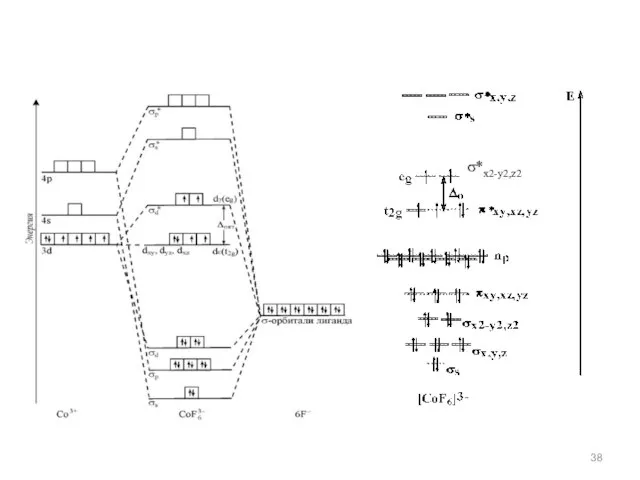
- 37. Лиганды, являющиеся π-акцепторами вызывают большее расщепление d-уровня; лиганды, являющиеся π-донорами, наоборот, вызывают малое расщепление d-уровня. По
- 38. σ*х2-у2,z2
- 39. Качественная диаграмма МО тетраэдрических комплексов. [СrО4]2-, [MnО4]- , [Be(OH)4]2-, [Zn(OH)4]2- Групповые орбитали лигандов для 3d металлов
- 40. Групповые орбитали лигандов Качественная диаграмма МО плоско-квадратных комплексов ([Ni(CN)4]2-, [AuCl4]- ) Для комплексов 3d металлов с
- 41. Темы докладов Металлоорганические комплексные соединения – источники молекулярных материалов. Использование комплексных соединений в технологических процессах выделения
- 43. Скачать презентацию







![Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-10.jpg)









![Строение октаэдрических комплексов с σ-связями металл-лиганд – [M(NH3)6]z+ Валентными орбиталями иона металла](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-31.jpg)
![Качественная диаграмма МО [M(NH3)6]z+ комплексов Электронная формула M(NH3)6]3+: (σs)2(σx,y,z)6(σx2-y2,z2)4(nxy,xz,yz)x (σ*x2-y2,z2)y (x+y=q)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-33.jpg)
![Электронное строение [M(NH3)6]z+ в рамках ТПЛ, ТКП, МВС МВС ТКП Шести электронным](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-35.jpg)

![Качественная диаграмма МО тетраэдрических комплексов. [СrО4]2-, [MnО4]- , [Be(OH)4]2-, [Zn(OH)4]2- Групповые орбитали](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-38.jpg)
![Групповые орбитали лигандов Качественная диаграмма МО плоско-квадратных комплексов ([Ni(CN)4]2-, [AuCl4]- ) Для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895981/slide-39.jpg)

 Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Натуральный каучук
Натуральный каучук Стекло. Виды стекла
Стекло. Виды стекла Электролиз и его применение
Электролиз и его применение Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Изменения, происходящие с веществами
Изменения, происходящие с веществами Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена
Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена Значение воды на Земле
Значение воды на Земле Многообразие органических веществ
Многообразие органических веществ Нуклеиновые кислоты
Нуклеиновые кислоты Заполни электронные уровни элементов
Заполни электронные уровни элементов Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Уксусная кислота
Уксусная кислота Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах 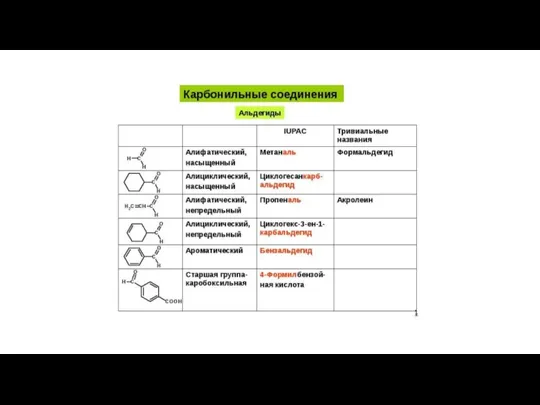 Карбонильные соединения (альдегиды)
Карбонильные соединения (альдегиды) Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Алкены. Гомологический ряд алкенов. Изомерия алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Качественные реакции в химии
Качественные реакции в химии Презентация на тему Основные законы химии
Презентация на тему Основные законы химии  Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера
Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера Химическая связь
Химическая связь Полимеры. Виды полимеров
Полимеры. Виды полимеров Оксиды и гидроксиды
Оксиды и гидроксиды Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів