Содержание
- 2. Химия это наука, изучающая свойства веществ и их превращения, которые сопровождаются изменением состава и/или строения. Любое
- 3. Строение атома
- 4. Историческая справка Термин «атом» ввел более 2,5 тысяч лет назад греческий учёный Демокрит. Он назвал так
- 5. Историческая справка В 1871 году Дмитрий Иванович Менделеев писал: «Легко предположить, что ныне пока нет еще
- 6. Открытия конца 19 в., показавшие сложность строения атомов: прохождение электрического тока в газах с возникновением катодных
- 7. Историческая справка В 1911 г. Эрнестом Резерфордом было окончательно установлено строение атома Атом состоит из маленького
- 8. Состав атома Атом - сложная микросистема находящихся в движении элементарных частиц. Атом состоит из положительно заряженного
- 9. Состав атома Пример Изотоны – атомы с одинаковым числом нейтронов. Изобары – атомы с одинаковым числом
- 10. Электронное строение атома Химические свойства атома определяет строение его электронной оболочки. Атомы имеют маленький размер, поэтому
- 11. Электронное строение атома В качестве модели нахождения электрона в атоме принято понятие об электронном облаке, плотность
- 12. Квантовые числа Каждую орбиталь и электрон атома можно однозначно описать с помощью четырех квантовых чисел (к.ч).
- 13. Квантовые числа l – орбитальное (азимутальное) квантовое число, характеризующее форму орбитали. Орбитальное к.ч. зависит от главного.
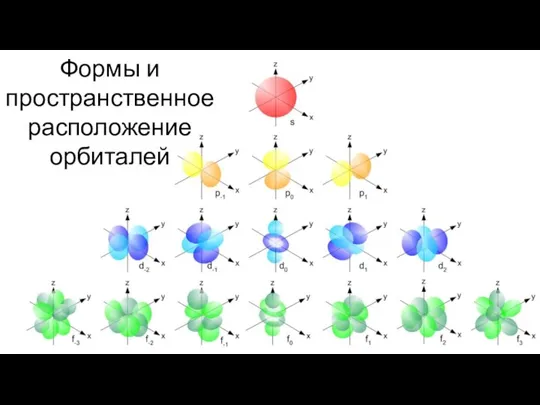
- 14. Формы орбиталей
- 15. Квантовые числа ml – магнитное квантовое число, характеризующее пространственное расположение орбиталей и указывает на число орбиталей
- 16. Квантовые числа Орбитали с одинаковой энергией называются вырожденными. Таким образом, p-состояние вырождено трехкратно, d-состояние – пятикратно,
- 17. Формы и пространственное расположение орбиталей
- 18. Схема энергетических уровней многоэлектронного атома
- 19. Схема энергетических уровней многоэлектронного атома
- 20. Квантовые числа ms – спиновое квантовое число, характеризующее вращение электрона вокруг собственной оси. ms = ±½
- 21. Правила заполнения орбиталей электронами 1. Правило минимальной энергии: Электроны стремятся занять в атоме низшую по энергии
- 22. Правила заполнения орбиталей электронами 2. Принцип Паули: В атоме не может быть двух электронов с одинаковым
- 23. Правила заполнения орбиталей электронами Следствие: орбитали заполняются электронами сначала по одному (ms=+½) т.е. направление стрелки наверх,
- 24. Правила заполнения орбиталей электронами 1е 1р 0n Нарушение правила минимальной энергии Нарушение принципа Хунда (суммарный спин
- 25. Правила заполнения орбиталей электронами 1H 1s1 Энергетическая диаграмма распределения электронов по орбиталям атома водорода Электронная конфигурация
- 26. Эффект электронного провала
- 27. Эффект электронного провала
- 29. Скачать презентацию

























 Кислоты. Оксиды
Кислоты. Оксиды Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Сплавы на основе магния и титана
Сплавы на основе магния и титана Тайна алмазов
Тайна алмазов Lektsia_6
Lektsia_6 Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение хімія
хімія Кислоты в химии
Кислоты в химии Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Презентация на тему Скорость химических реакций
Презентация на тему Скорость химических реакций  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Коррозия металлов
Коррозия металлов Алкены. Ҳимические свойства алкенов
Алкены. Ҳимические свойства алкенов Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии 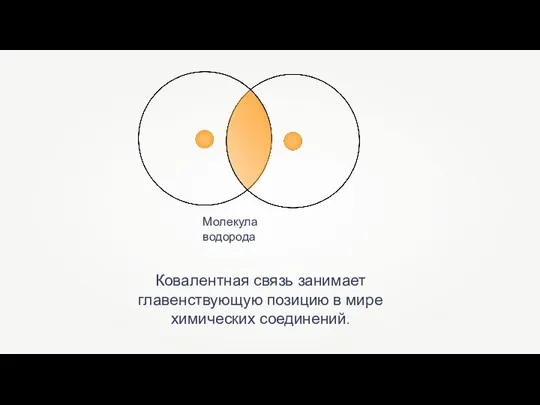 Ковалентная химическая связь
Ковалентная химическая связь Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Заполни электронные уровни элементов
Заполни электронные уровни элементов Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Оксиды и основания
Оксиды и основания Электролиз
Электролиз Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք
Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи Соединения азота
Соединения азота