Слайд 21. Классифицируйте вещества:
SO2 8) Cu
Mg(OH)2 9) Cl2
HNO3 10) FeCl3
NaNO3 11) NaOH
H3PO4 12)
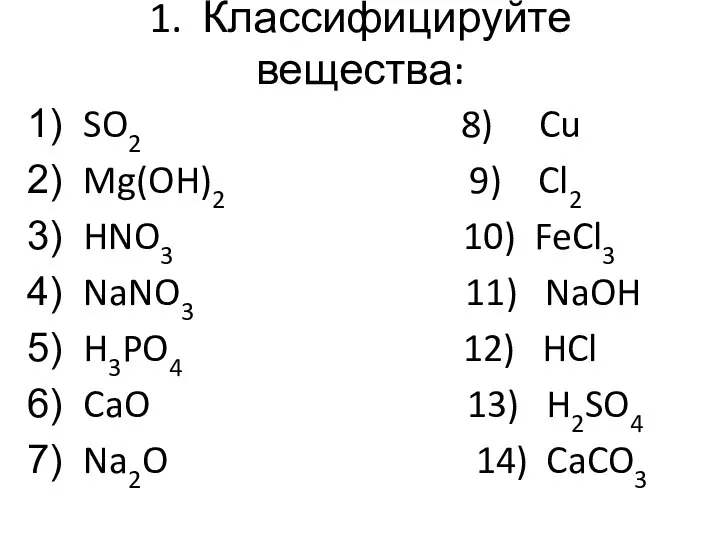
HCl
CaO 13) H2SO4
Na2O 14) CaCO3
Слайд 32. Запишите уравнения реакций:
А) С какими из выше перечисленных веществ будет реагировать

раствор серной кислоты?
Б) С какими из выше перечисленных веществ будет реагировать раствор гидроксида натрия ?
Слайд 43. Запишите уравнения возможных реакций:
Оксид калия + вода
Нитрат магния + гидроксид натрия
Медь

+ серная кислота
Цинк + соляная кислота
Карбонат натрия + азотная кислота
Хлорид натрия + гидроксид калия
Серная кислота + оксид меди (ll)
Слайд 54. Задача.
Определите массу соли, полученной при взаимодействии 60 г гидроксида натрия

с углекислым газом.
Слайд 65.
Определите концентрацию раствора, полученного при растворении 25 г соли в 155 г

воды.
Слайд 76.
В растворе массой 240 г содержится 80 г соли. Определите концентрацию данного

раствора.
Слайд 87.
Как изменяются металлические свойства в ряду элементов:
А) Mg ? Al ?

Si
Б) Mg ? Ca ? Sr
В) N ? B ? Li
В ряду элементов : S ? O ? F
А) увеличивается число валентных электронов
Б) увеличивается число электронных уровней
В) увеличиваются неметаллические свойства
Г) увеличивается радиус атомов







 Топливо и расчеты его горения
Топливо и расчеты его горения Задача на химическое равновесие
Задача на химическое равновесие Презентация на тему Электролиз
Презентация на тему Электролиз  Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Повторение пройденного
Повторение пройденного 8-9-10 химические формулы
8-9-10 химические формулы Prezentatsia_k_uroku
Prezentatsia_k_uroku Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Методология пробoотбора с использованием ТЧЭ
Методология пробoотбора с использованием ТЧЭ Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Химическая термодинамика
Химическая термодинамика Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Строение атома
Строение атома Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) metally_mikhaylets
metally_mikhaylets Презентации 1 строение атома
Презентации 1 строение атома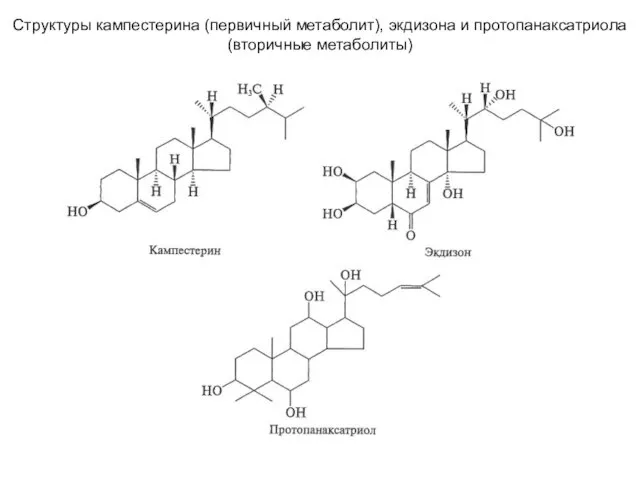 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Силикатная промышленность
Силикатная промышленность Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Никель и его соединения
Никель и его соединения Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2)