Содержание
- 2. Виды оксидов азота N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 N2O – оксид
- 3. N2O- оксид азота (I) II IV II N=N=O Против всех правил Степень окисления не всегда совпадает
- 4. Оксид азота (I) N2O Получение. Разложение нитрата аммония при нагревании: NH4NO3 = N2O + 2H2O Нагрев
- 5. NO-оксид азота (II) Несолеобразующий оксид. Бесцветный газ, не имеет запаха. В воде малорастворим. Термически устойчив. Образуется
- 6. Оксид азота (II) NO Получение. 1. При реакции неактивных металлов с разбавленной азотной кислотой: 3Cu +
- 7. Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства. 1. При обычной температуре
- 8. N2O3-оксид азота (III) Жидкость, темно – синего цвета, термически неустойчива, t кип.= 3,5 С, т. е.
- 9. Оксид азота (III) N2O3 Получить можно при сильном охлаждении эквимолярной смеси NO и NO2: NO +
- 10. Оксид азота (IV) «Лисий хвост» Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
- 11. Оксид азота (IV) NO2 Получение. Термическим разложением нитратов металлов, расположенных в ряду активности в интервале Al-Сu:
- 12. Оксид азота (IV) NO2 Химические свойства. Взаимодействие с водой: 2NO2 + H2O(хол) = HNO3 + HNO2
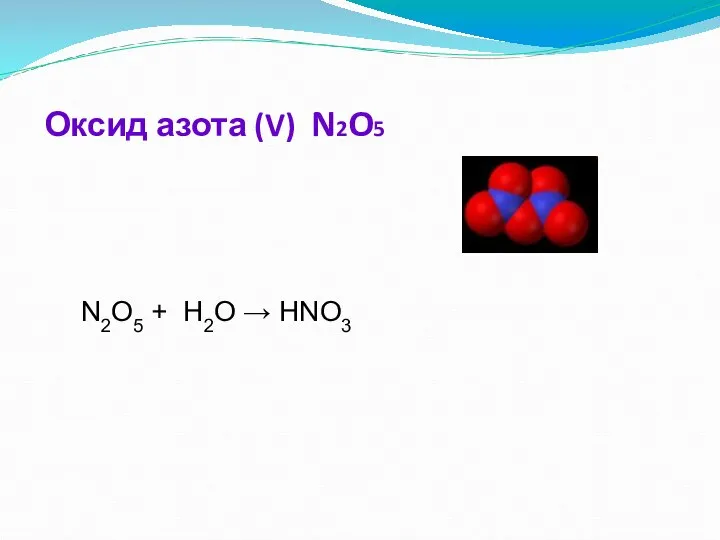
- 13. Оксид азота (V) Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты : N2O5
- 14. Химические свойства. Оксид азота(V) - кислотный оксид. 1. При растворении в воде образует азотную кислоту: N2O5
- 15. Оксид азота (V) N2O5 N2O5 + H2O → HNO3
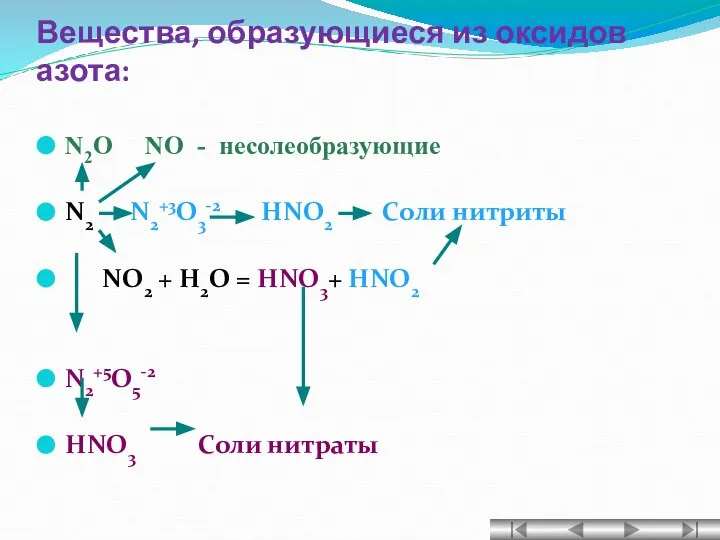
- 16. Вещества, образующиеся из оксидов азота: N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 +
- 17. Обобщающие задания. 1.Имеются три закрытых цилиндра: с оксидом азота (IV), с азотом, с аммиаком. Как проще
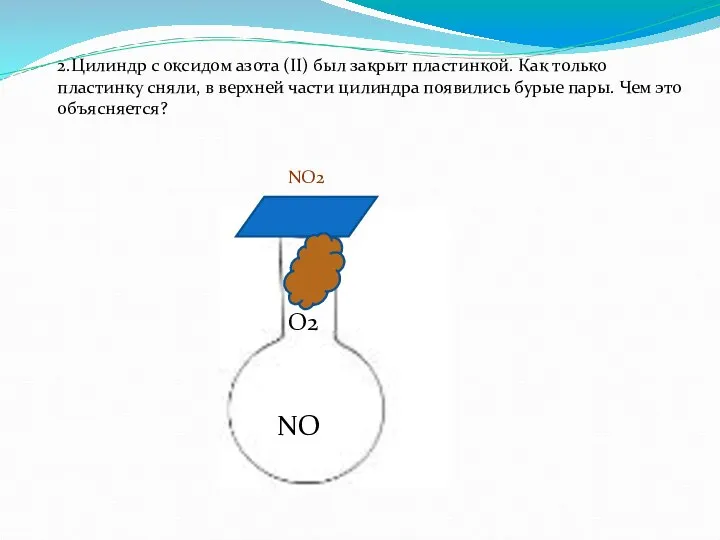
- 18. 2.Цилиндр с оксидом азота (II) был закрыт пластинкой. Как только пластинку сняли, в верхней части цилиндра
- 19. Кислотные дожди
- 20. Влияние кислотных дождей на животных
- 22. Скачать презентацию
















 Кроссворд первоначальные понятия
Кроссворд первоначальные понятия Природа и классификация химических связей
Природа и классификация химических связей Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Гидролиз солей
Гидролиз солей Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Основания. 8 класс
Основания. 8 класс Чистые вещества и смеси
Чистые вещества и смеси Азот в сельском хозяйстве
Азот в сельском хозяйстве Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым Основания и их свойства
Основания и их свойства Получение пластмасс
Получение пластмасс Тазалау. Тазалаудың мақсаты
Тазалау. Тазалаудың мақсаты Пористые стекла
Пористые стекла Теория электролитической диссоциации
Теория электролитической диссоциации Химия вокруг нас и для нас
Химия вокруг нас и для нас Валентные состояния атома углерода
Валентные состояния атома углерода Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Самостоятельная работа
Самостоятельная работа Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Нефть. Черное золото или черная смерть
Нефть. Черное золото или черная смерть Алкены
Алкены Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Презентация по Химии "Химические свойства галогенов"
Презентация по Химии "Химические свойства галогенов"  Степени окисления
Степени окисления