Слайд 2Изучаем темы
Химические свойства щелочей:
взаимодействие с кислотными оксидами,
кислотами,

растворами солей.
Получение щелочей на примере реакции гашения извести.
Составление уравнений соответствующих реакций.
Слайд 3Щелочи
Растворимые в воде сильные основания (основания щелочных и щелочноземельных металлов) называют

щелочами, например: NaOH, Ba(OH)2, KOH, LiOH, Ca(OH)2.
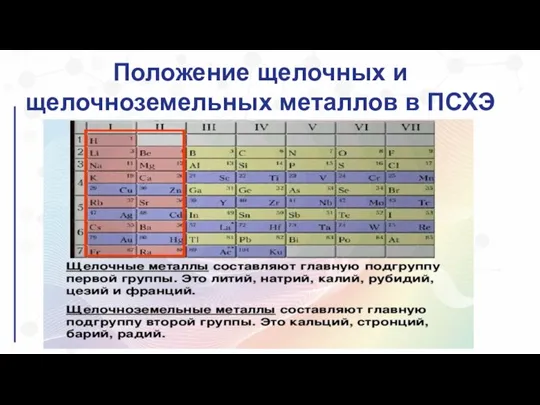
Слайд 4Положение щелочных и щелочноземельных металлов в ПСХЭ
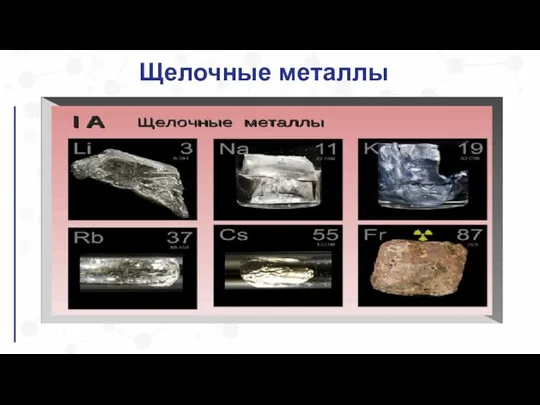
Слайд 10Хранение щелочных и щелочноземельных металлов

Слайд 11Ca(OH)2
Не следует путать силу основания и его растворимость.
Например, гидроксид кальция, Ca(OH)2

– сильное основание, хотя его растворимость в воде невелика. В данном случае сильным основанием (щелочью) называют ту часть гидроксида кальция, которая растворена в воде (известковая вода).
Слайд 13Физические свойства щелочей
Щелочи – это твердые кристаллические вещества, растворимые в воде.

Их растворы мылки на ощупь. Гидроксиды щелочных металлов (NaOH, KOH) гигроскопичны (поглощают из воздуха водяные пары и расплываются).
Слайд 14Физические свойства щелочей
Щелочи вызывают сильные химические ожоги при попадании на кожу

или в глаза, поэтому при работе с ними требуется жесткое соблюдение правил безопасности: работать с концентрированными растворами щелочей следует аккуратно, обязательно использовать защитные очки.
Слайд 16Химические свойства щелочей
1. Растворы щелочей действуют на индикаторы, изменяя их окраску:
лакмус становится

синим, метилоранж – жёлтым, фенолфталеин - малиновым
Слайд 17Химические свойства щелочей
2. Взаимодействие с кислотами по реакции обмена
(реакция нейтрализации):
Щелочь +

Кислота = Соль + Вода
Слайд 18Химические свойства щелочей
Примеры:
3NaOH + H3PO4 = Na3PO4 + 3H2O
Cа(OH)2 + 2HCl =

CаCl2 + 2H2O
Слайд 19Химические свойства щелочей
3. Взаимодействуют с кислотными оксидами:
Щелочь + Кислотный оксид = Соль

+ Вода
Слайд 20Химические свойства щелочей
Примеры:
2KOH + CO2 → K2CO3 + H2O
Ba(OH)2 + SO3 →

BaSO4↓ + H2O
Слайд 21Химические свойства щелочей
Примеры:
2KOH + N2O5 = 2KNO3 + H2O
6NaOH + P2O5 =

2Na3PO4+ 3Н2О
Слайд 22Химические свойства щелочей
Примеры:
2KOH + SiO2 = K2SiO3 + H2O
Ca(OH)2 + Cl2O7 =

Ca(ClO4)2 + H2O
Слайд 23Химические свойства щелочей
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Реакция взаимодействия гидроксида кальция

с углекислым газом (CO2) является качественной реакцией на углекислый газ.
Качественная реакция – реакция, которая позволяет обнаружить тот или иной ион, вещество или функциональную группу.
Слайд 24Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется малорастворимое или

газообразное соединение:
Щелочь + Соль = Соль + Основание
Слайд 25Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется нерастворимая соль:
Примеры:
Ba(OH)2

+ K2SO4 → 2KOH + BaSO4↓
Ba(OH)2 + Li2SO4 → 2LiOH + BaSO4↓
Слайд 26Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется нерастворимая соль:
Примеры:

Ca(OH)2 + K2CO3 → 2KOH + CaCO3↓
Слайд 27Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется нерастворимое основание:
Примеры:

2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Слайд 28Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется нерастворимое основание:
Примеры:

Слайд 29Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется нерастворимое основание:
Примеры:

6NaOH + Cr2(SO4)3 → 3Na2SO4 + 2Cr(OH)3↓
Слайд 30Химические свойства щелочей
4. Взаимодействуют с cолями, если в результате образуется газообразное вещество:

Ca(OH)2 + NH4Cl → NH3↑ + H2O +NaCl
Слайд 31Получение щелочей
1. Реакции активных металлов (щелочных и щелочноземельных) с водой:
2Na

+ 2H2O → 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2K + 2H2O → 2KOH + H2↑
Слайд 32Получение щелочей
2. Взаимодействие оксидов активных металлов с водой:
Примеры:
CaO + H2O →Ca(OH)2

– реакция гашения извести
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Слайд 33Получение щелочей
3. Электролиз водных растворов солей:
2NaCl + 2H2O –эл-з→ 2NaOH +

H2↑ + Cl2↑
Слайд 34Выводы
Щелочи – твердые кристаллические вещества, растворимые в воде.
- Щелочи образуют только щелочные

и щелочноземельные металлы.
- Получают щелочи реакцией щелочных и щелочноземельных металлов, а также их оксидов с водой; электролизом растворов солей активных металлов.
- Щелочи взаимодействуют с кислотами, с кислотными оксидами. А также с растворами некоторых солей.


































 Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Планарные потенциометрические сенсоры на основе пилларарена -DNS-162
Планарные потенциометрические сенсоры на основе пилларарена -DNS-162 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гетероциклические соединения
Гетероциклические соединения Нефть
Нефть Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Характеристика высших гидроксидов по положению в ПСХЭ
Характеристика высших гидроксидов по положению в ПСХЭ Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Степень окисления
Степень окисления Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Голубое золото
Голубое золото Строение электронных оболочек
Строение электронных оболочек Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Химическая связь
Химическая связь Свойства воды
Свойства воды Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Арены. 10 класс
Арены. 10 класс Углерод
Углерод Конспект по химии
Конспект по химии История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Химический состав растений
Презентация на тему Химический состав растений  Альдегиды и кетоны
Альдегиды и кетоны Изомерия
Изомерия Химия липидов
Химия липидов Презентация на тему Алканы
Презентация на тему Алканы  Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений Кислотные оксиды, основные оксиды, индикаторы
Кислотные оксиды, основные оксиды, индикаторы