Содержание
- 2. Фактор эквивалентности (fэ) – число, обозначающее какая доля реальной частицы вещества Х эквивалентна одному иону водорода
- 3. Пример. Определите фактор эквивалентности для магния. fэ(Mg) = = Пример. Определите фактор эквивалентности для серы в
- 4. Молярная масса эквивалента вещества (Мэ(Х)) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности
- 5. Пример. Определите молярную массу эквивалента хрома в Cr 2S3. 3+ fэ(Сr) = = Мэ(Cr) = ⋅52
- 6. Если одно из реагирующих веществ или продуктов реакции (участников реакции) - газ, то для него вводится
- 7. Например, при нормальных условиях (P=760 мм.рт.ст., t = 0 оС) 1 моль эквивалентов водорода занимает объем,
- 8. Например, при нормальных условиях 1 моль эквивалентов кислорода занимает объем, равный Vэ(О2) = = 5,6 л/моль
- 9. Закон эквивалентов В химических реакциях вещества, взаимодействующие между собой, и образующиеся продукты реакции имеют равные эквивалентные
- 10. Закон эквивалентов – массы реагирующих веществ пропорциональны молярным массам эквивалентов этих веществ (для твердых и жидких
- 11. Если известно, что одно из веществ газ, то закон эквивалентов записывается в виде: где m1, m2,
- 12. Пример. При сгорании 5г металла образуется 9,44 г оксида металла. Рассчитайте молярную массу эквивалента металла. xМе
- 13. Определение фактора эквивалентности и молярной массы эквивалента сложных веществ по их формулам. Оксиды fэ(оксида) = где
- 14. Например. fэ(Al3+2O3) = = = Мэ(Al2O3) = fэ(Al2O3)⋅М(Al2O3) = ⋅102 = 17 г/моль
- 15. Кислоты где n – основность кислоты (число катионов водорода, способных замещаться на катионы металла), М (кислоты)
- 16. Например. fэ(H3PO4) = = Мэ(H3PO4) = fэ(H3PO4)⋅М(H3PO4) = ⋅98 = 32,7 г/моль
- 17. Основания где n – кислотность основания (число гидроксо-анионов, способных замещаться на кислотные остатки), М(основания) – молярная
- 18. Например. fэ(Са(OH)2) = = Мэ(Са(OH)2) = fэ(Са(OH)2)⋅М(Са(OH)2) = ⋅74 = 37 г/моль
- 19. Соли fэ(соли) = где Z – суммарный заряд катиона основного остатка или анионов кислотного остатка (Z
- 20. Например. fэ(Са3(PO4)2) = = = Мэ(Са3(PO4)2) = fэ(Са3(PO4)2)⋅М(Са3(PO4)2) = ⋅136 = 22,7 г/моль =
- 21. Определение количества эквивалентов и фактора эквивалентности вещества в кислотно-основных реакциях KOH + H3PO4 = KH2PO4 +
- 22. H3PO4 + 2KOH = K2HPO4 + 2H2O 2K++ 2OH- + 2H++HPO42- = 2K++HPO42- +2H2O Делим коэффициенты
- 23. H3PO4 + 3KOH = K3PO4 + 3H2O Делим коэффициенты в уравнении на количество участвующих в реакции
- 25. Скачать презентацию












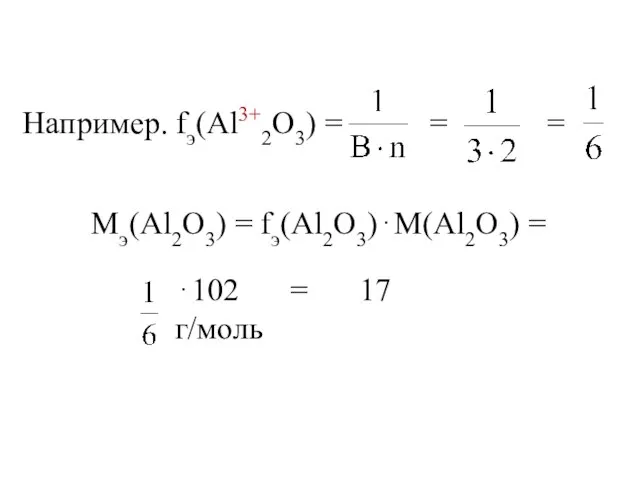

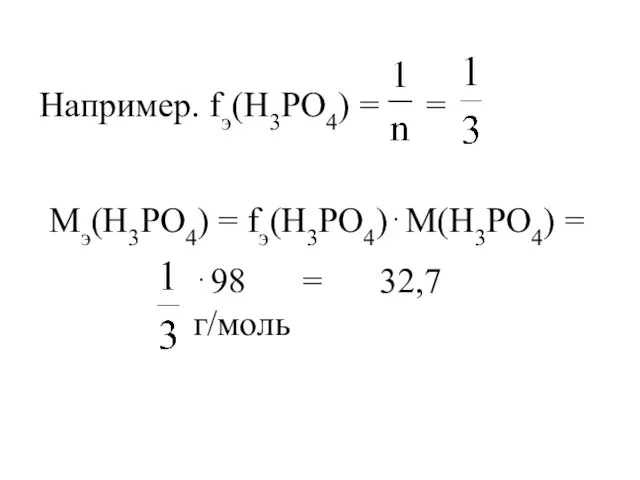

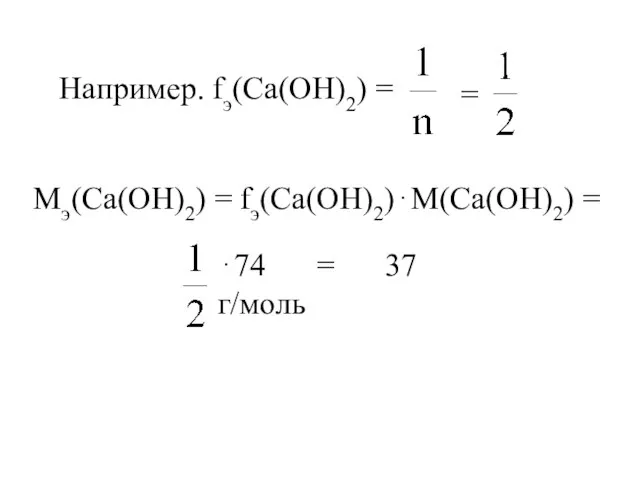

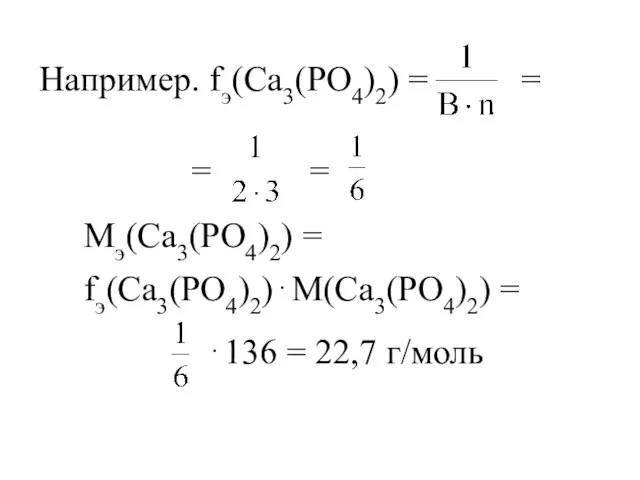


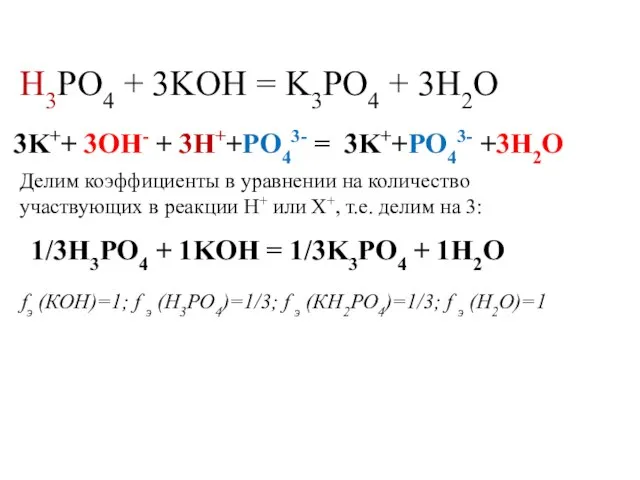
 Классификация и свойства кислот
Классификация и свойства кислот Фосфорные удобрения
Фосфорные удобрения Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Типы химических реакций
Типы химических реакций Циклоалканы. Строение молекул
Циклоалканы. Строение молекул Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Метаморфизм
Метаморфизм Полиуретаны. Структура и строение
Полиуретаны. Структура и строение Основные классы неорганических соединений
Основные классы неорганических соединений Классификация неорганических веществ
Классификация неорганических веществ Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Типичные ошибки выпускников при решении задач ЕГЭ по органической химии
Типичные ошибки выпускников при решении задач ЕГЭ по органической химии Викторина Что это?
Викторина Что это? Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Тренажер Химическая азбука для учащихся 8 класса
Тренажер Химическая азбука для учащихся 8 класса Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак Медь и её сплавы
Медь и её сплавы Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Техника безопасности при работе в химическом кабинете
Техника безопасности при работе в химическом кабинете Применение алкинов
Применение алкинов Графит. Химические свойства
Графит. Химические свойства Презентация на тему Уравнение Менделеева-Клапейрона
Презентация на тему Уравнение Менделеева-Клапейрона  Характеристика углерода
Характеристика углерода Парфюмерные товары
Парфюмерные товары