Содержание
- 2. СПИРТЫ
- 3. ОПРЕДЕЛЕНИЕ Спирты – это органические вещества, содержащие одну или несколько гидроксильных групп - OH, соединённых с
- 4. По числу гидроксильных групп спирты делятся на: Одноатомные: (метиловый спирт) Двухатомные: (этиленгликоль) Трехатомные: (глицерин) CH3 OH
- 5. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: Первичные, в молекулах которых
- 6. По характеру у/в радикала выделяются следующие спирты: Предельные, содержа -щие в молекуле лишь предельные у/в радикалы
- 7. Номенклатура и изомерия Название этого класса соединений образовано из суффиксов –ан и –ол H H C
- 8. Предельные одноатомные спирты это органические вещества, состоящие из одной гидроксильной группы –ОН и предельного углеводородного радикала.
- 9. Общая формула R - OH CH3OH - метиловый ( метанол) C2H5OH – этиловый (этанол) - алкоголь
- 10. Физические свойства Низшие спирты (С1 - С11) - жидкости, имеющие характерный алкогольный запах и жгучий вкус,
- 11. Влияние спиртов на организм человека. Метанол – сильный яд!!! При попадании 1 – 2 г метанола
- 12. Химические свойства 1. Горение (синее пламя) С2 Н5ОН + 3 О2 → 2 СО2 + 3
- 13. 3) Реакция дегидратации (отщепление воды) а) внутримолекулярная С2Н5ОН → С2Н4 + НОН б) межмолекулярная СН3 –
- 14. Получение спиртов 1) Из крахмалсодержащих продуктов 2) Из целлюлозы 3) Из сахаристых веществ 4) Гидратация алкенов
- 15. Применение спиртов
- 16. Производство уксусной кислоты
- 17. Медицина
- 18. Спиртовые термометры
- 19. Горючее для автотранспорта
- 20. Синтетические каучуки и резина
- 21. Парфюмерия
- 22. Лаки, краски, растворители
- 23. Взрывчатые вещества
- 24. Многоатомные спирты это органические вещества, содержащие более одной гидроксильной группы – ОН.
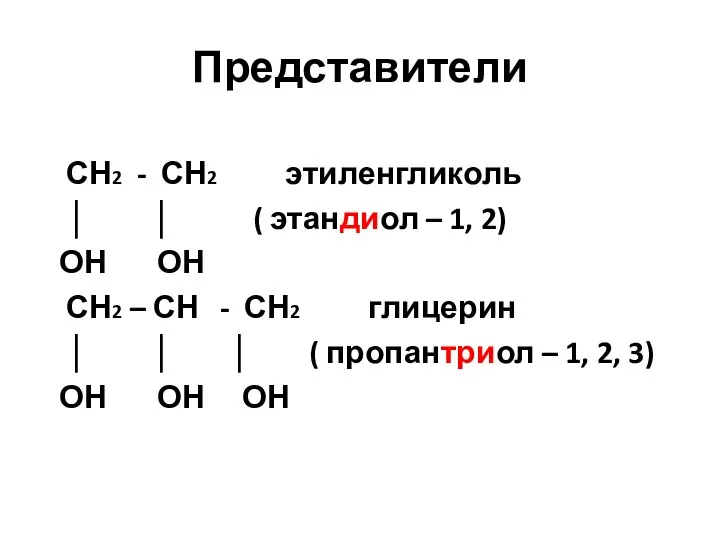
- 25. Представители СН2 - СН2 этиленгликоль │ │ ( этандиол – 1, 2) ОН ОН СН2 –
- 26. Физические свойства Этиленгликоль и глицерин – бесцветные, вязкие жидкости, сладковатые на вкус, тяжелее воды, хорошо растворяются
- 27. Применение этиленгликоля
- 28. Антифризы
- 29. Взрывчатые вещества
- 30. Волокно лавсан
- 31. Применение глицерина
- 32. Взрывчатые вещества (динамит)
- 33. Парфюмерия
- 34. Медицина
- 35. Кожевенное производство (смягчение кожи)
- 36. Смягчение тканей
- 37. Олифы и краски
- 38. Химические свойства 1. Реакции сходные с одноатомными спиртами
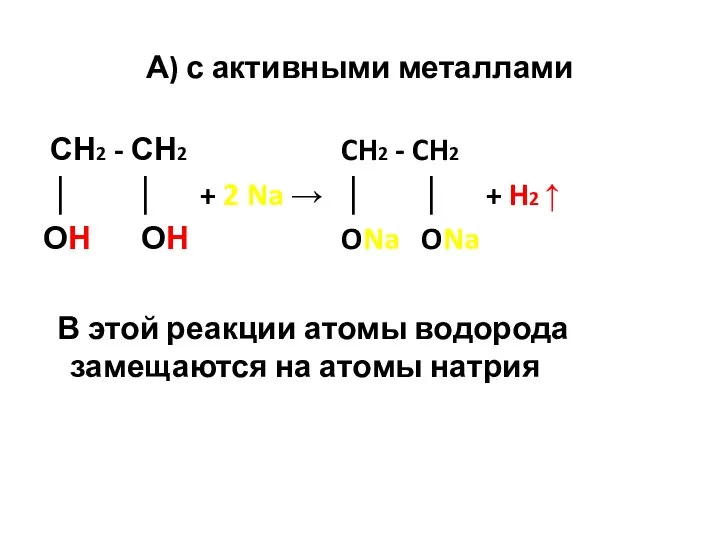
- 39. А) с активными металлами СН2 - СН2 CH2 - CH2 │ │ + 2 Na →
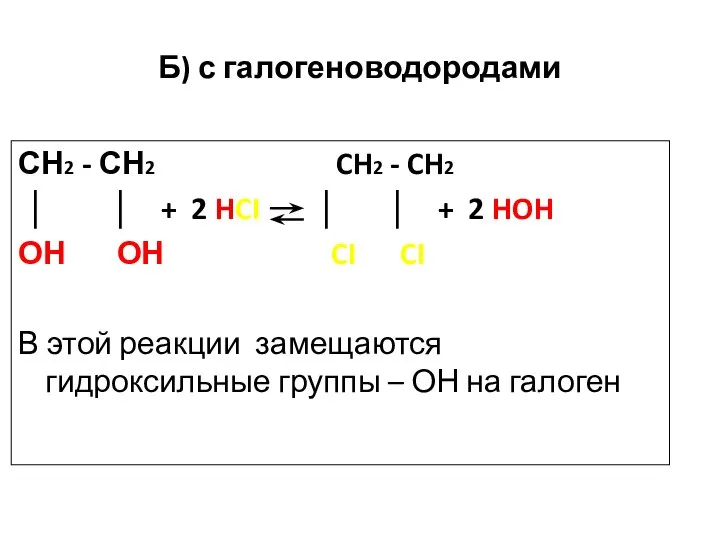
- 40. Б) с галогеноводородами СН2 - СН2 CH2 - CH2 │ │ + 2 HCI │ │
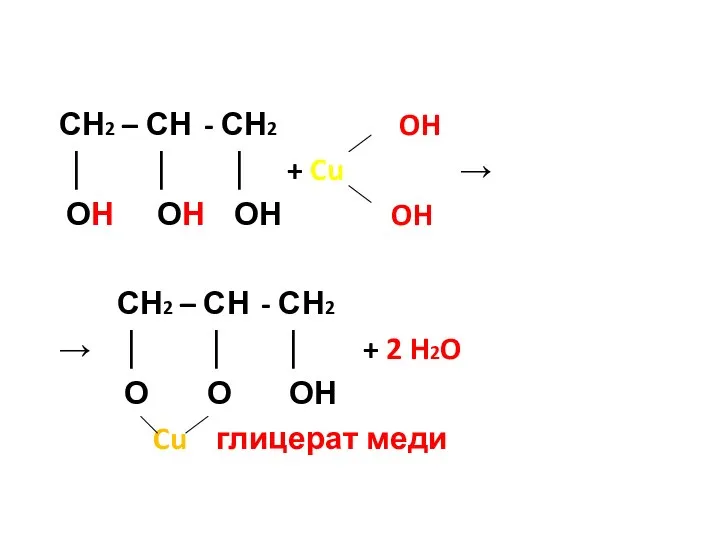
- 41. 2. Специфические свойства многоатомных спиртов А) Качественная реакция. При взаимодействии глицерина с гидроксидом меди (II) –
- 42. СН2 – СН - СН2 OH │ │ │ + Cu → ОН ОН ОН OH
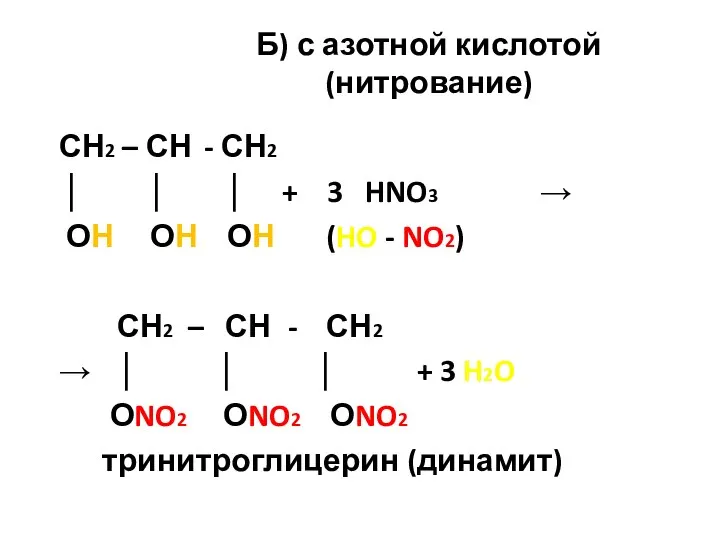
- 43. Б) с азотной кислотой (нитрование) СН2 – СН - СН2 │ │ │ + 3 HNO3
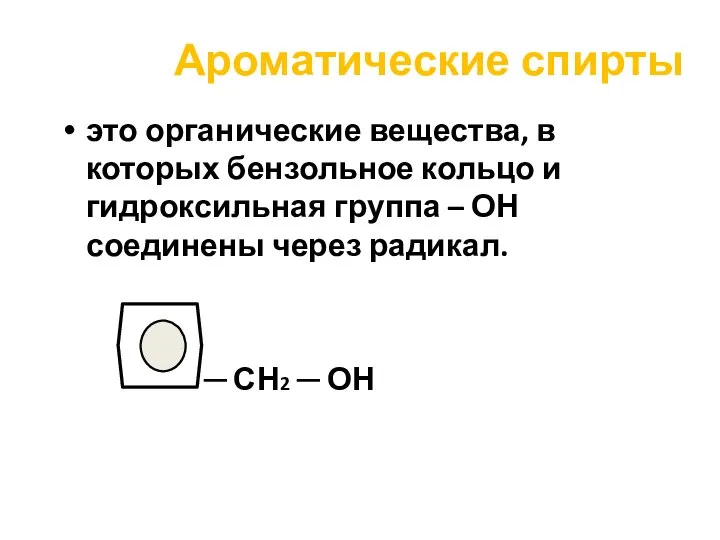
- 44. Ароматические спирты это органические вещества, в которых бензольное кольцо и гидроксильная группа – ОН соединены через
- 45. Ф Е Н О Л
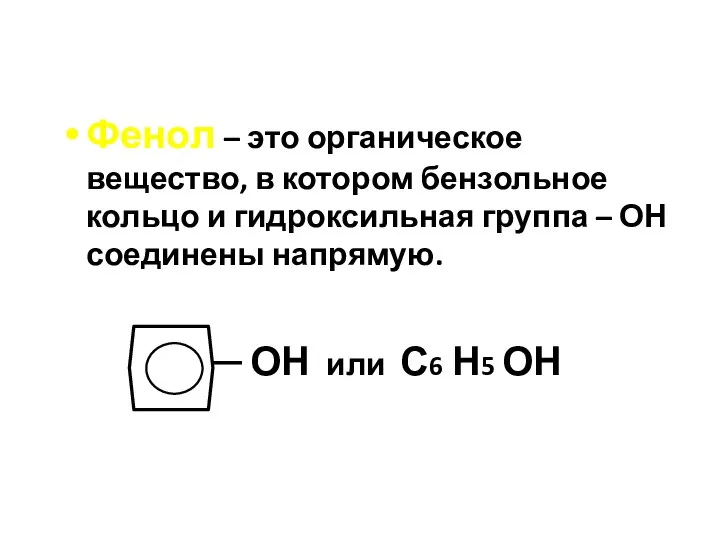
- 46. Фенол – это органическое вещество, в котором бензольное кольцо и гидроксильная группа – ОН соединены напрямую.
- 47. Физические свойства Фенол – бесцветное, кристаллическое вещество с характерным запахом. На воздухе розового цвета ( вследствие
- 48. Химические свойства 1. Горение С6Н5ОН + 7 О2 → 6 СО2 + 3 Н2О + Q
- 49. 3. Отличительные свойства фенола а) со щелочами С6Н5ОН + NaОН → C6H5ONa + H2О б) Качественная
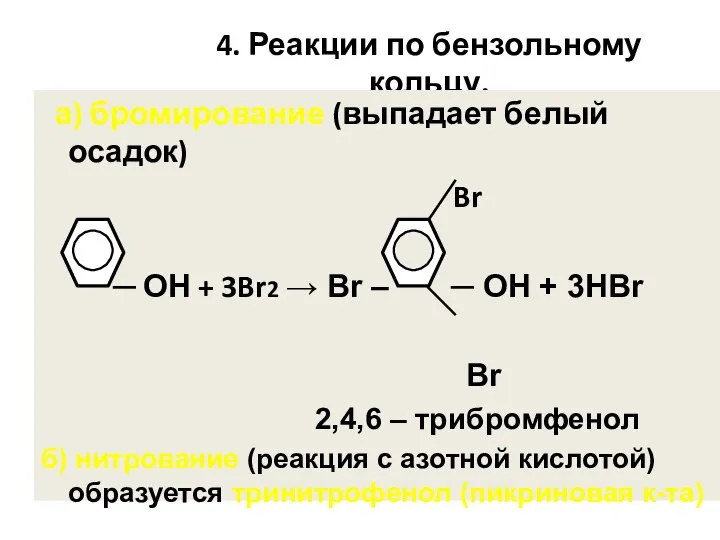
- 50. 4. Реакции по бензольному кольцу. а) бромирование (выпадает белый осадок) Br ─ ОН + 3Br2 →
- 51. б) нитрование (реакция с азотной кислотой) образуется тринитрофенол (пикриновая кислота) Пикриновая кислота – кристаллическое взрывчатое вещество
- 52. Получение фенола Фенол впервые получил П.Э.Бертло (1851г) Сейчас фенол получают двумя способами. Из каменноугольной смолы Синтетический
- 53. Влияние фенола на живые организмы. Охрана окружающей среды. Фенол и его производные – яды, очень опасные
- 54. Применение фенола 1) Как вещество, убивающее многие микроорганизмы, фенол давно применяют в виде водного раствора для
- 55. 2) лекарства
- 56. 3) красители
- 57. 4) Волокно капрон
- 58. 5) Взрывчатые вещества
- 59. 6) Фенолформальдегидные пластмассы
- 61. Скачать презентацию














































 Презентация на тему Палладий
Презентация на тему Палладий  Природные источники углеводородов
Природные источники углеводородов Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой Аналитическая химия. Введение
Аналитическая химия. Введение Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Физическое явление в химии
Физическое явление в химии Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона относительная атомная масса
относительная атомная масса Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия День химии
День химии Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс
Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс Презентация на тему Каучук
Презентация на тему Каучук  Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов
Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов Химическая замена
Химическая замена Основания, их состав и название
Основания, их состав и название Основные классы неорганических соединений
Основные классы неорганических соединений Сложные неорганические вещества
Сложные неорганические вещества Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Кислоты. Тест
Кислоты. Тест Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип
Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип Презентация на тему Графен - материал будущего
Презентация на тему Графен - материал будущего