Содержание
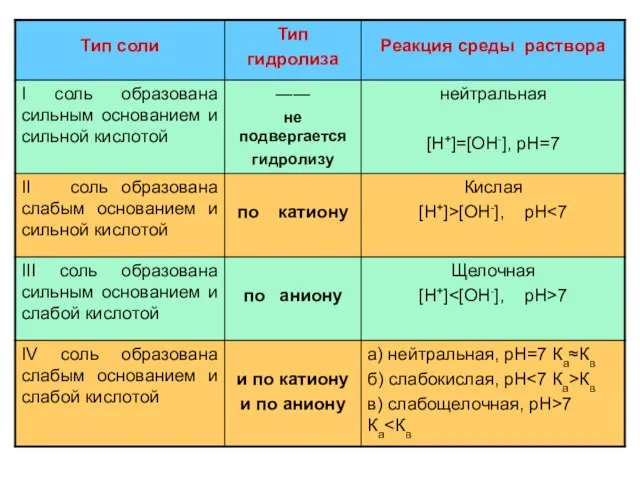
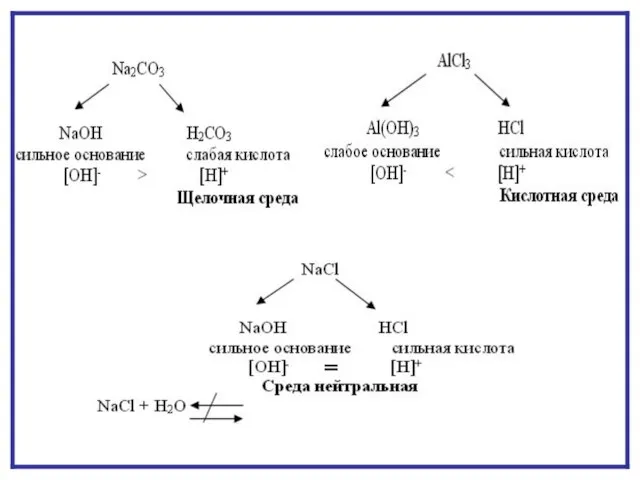
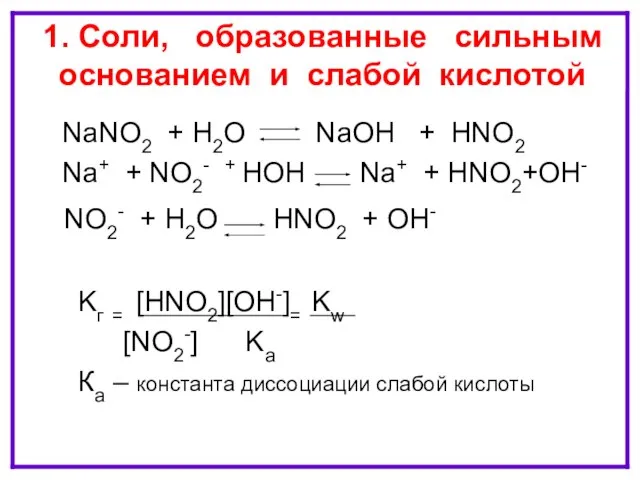
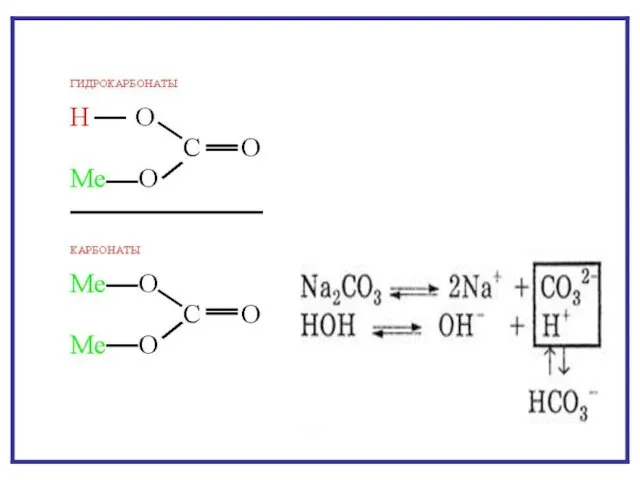
- 7. ГИДРОЛИЗ ПО АНИОНУ NaNO2 + H2O NaOH + HNO2 Na+ + NO2- + HOH Na+ +
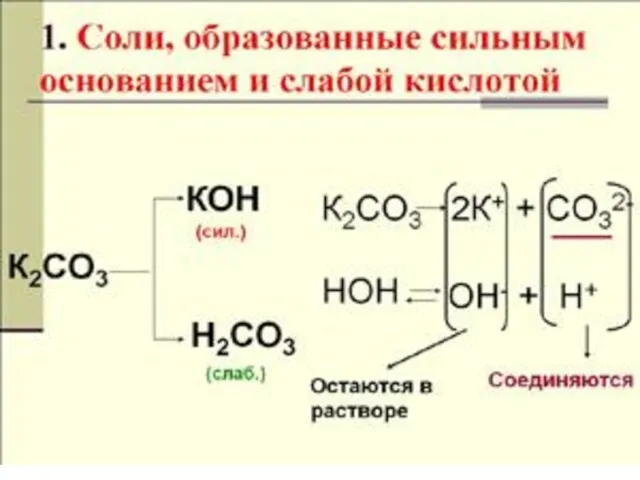
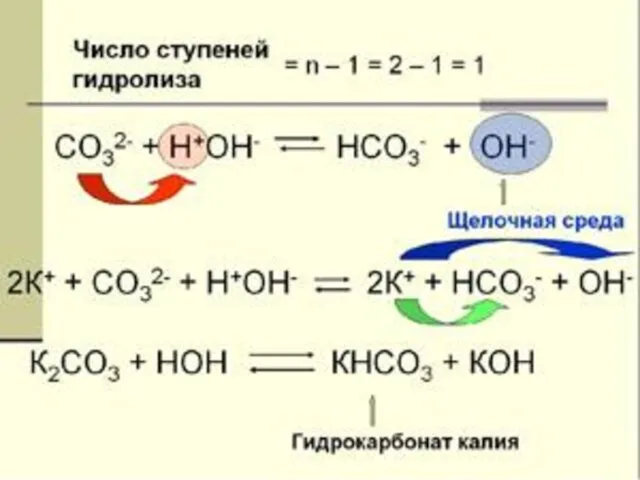
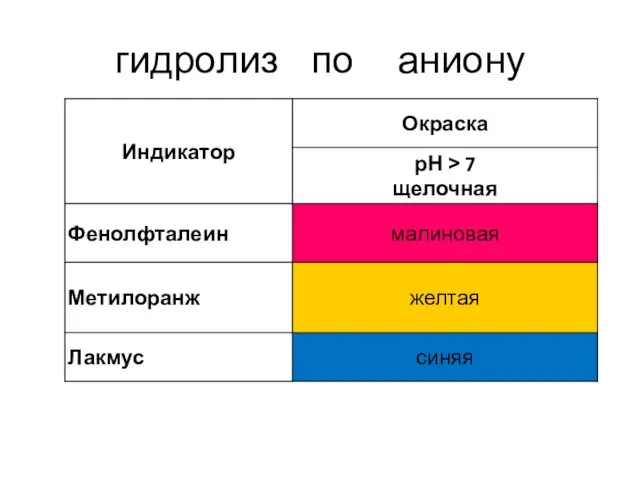
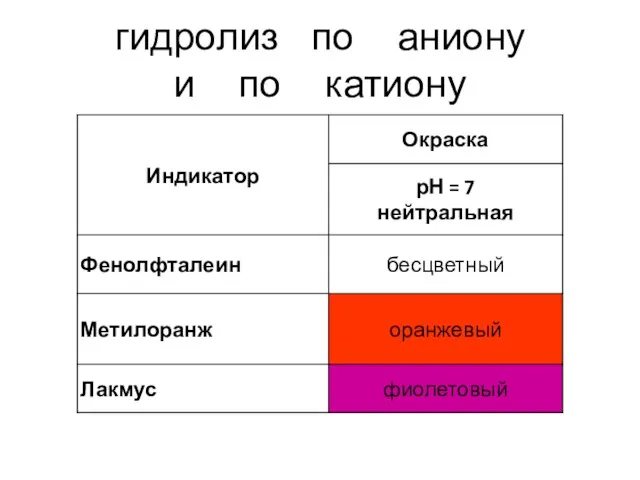
- 11. гидролиз по аниону
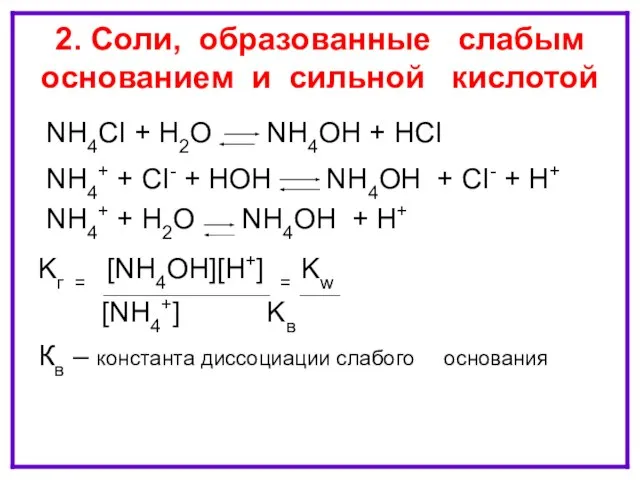
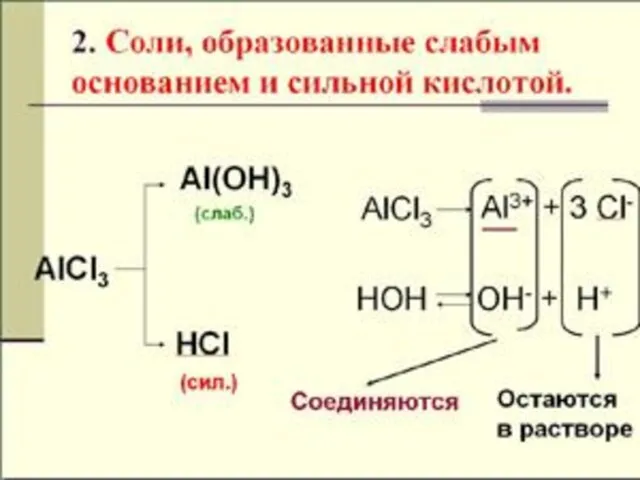
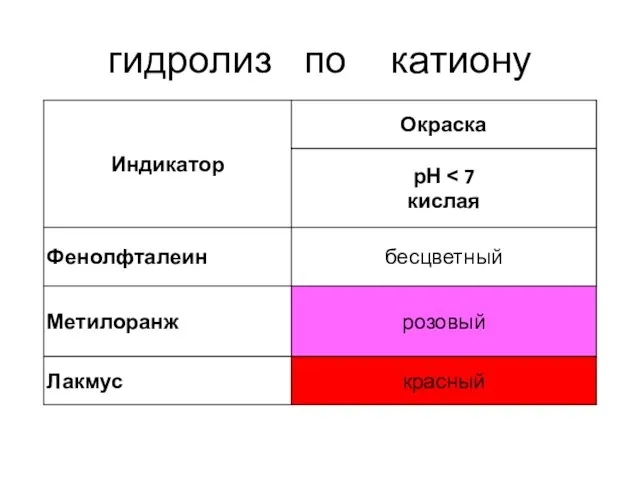
- 12. ГИДРОЛИЗ ПО КАТИОНУ NH4CI + H2O NH4OH + HCI NH4+ + CI- + HOH NH4OH +
- 17. гидролиз по катиону
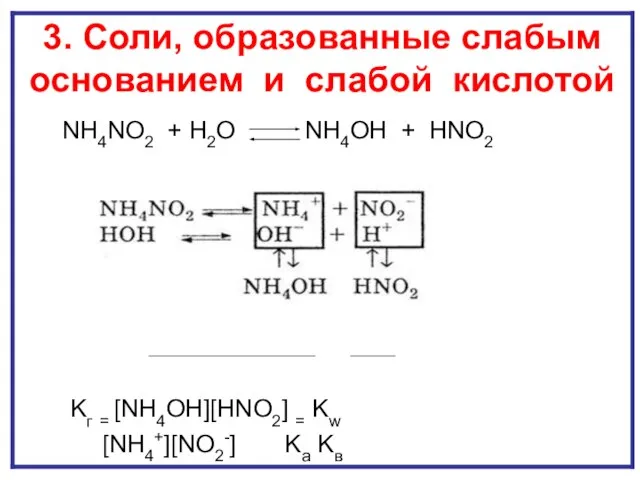
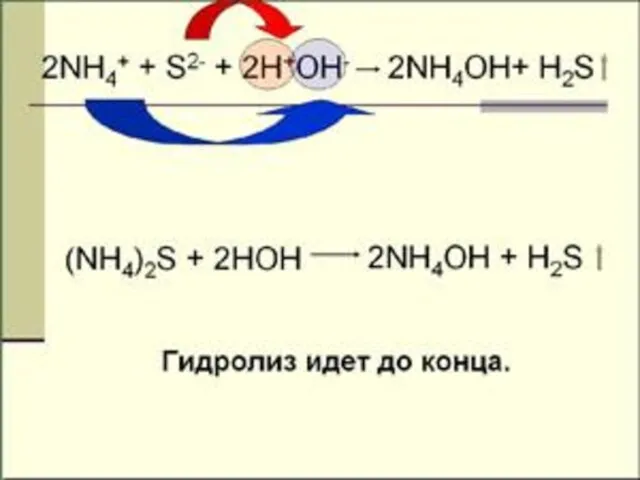
- 18. ГИДРОЛИЗ И ПО КАТИОНУ И ПО АНИОНУ NH4NO2 + H2O NH4OH + HNO2 Kг = [NH4OH][HNO2]
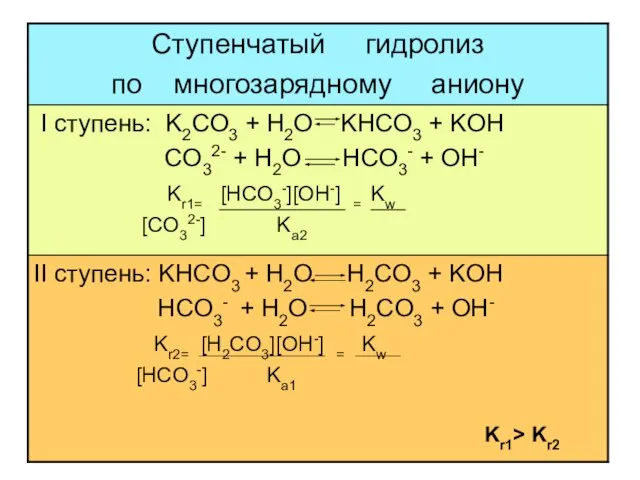
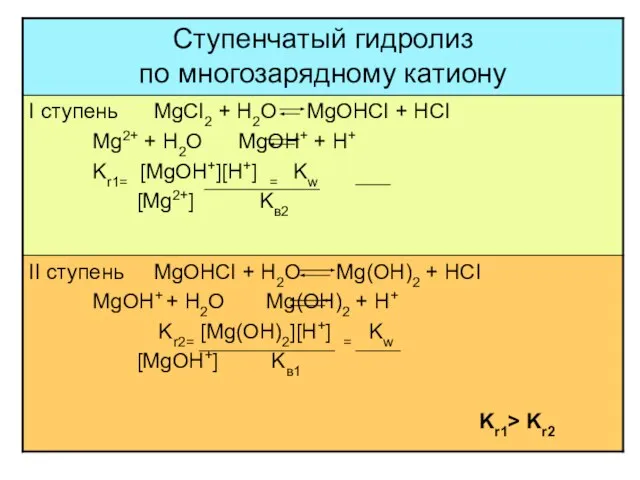
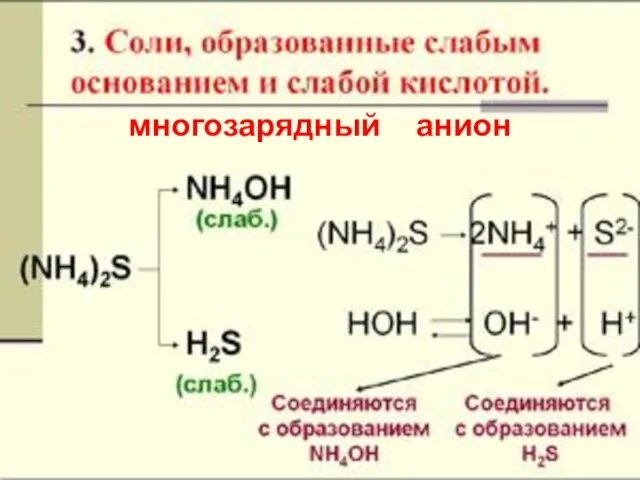
- 19. многозарядный анион
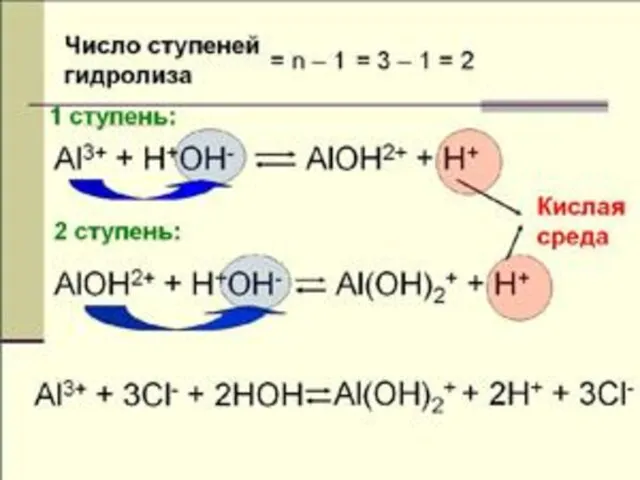
- 21. гидролиз по аниону и по катиону
- 22. Гидролиз некоторых солей также идет до конца, например, Al2S3 + 6H2O → 2 Al(OH)3 ↓ +
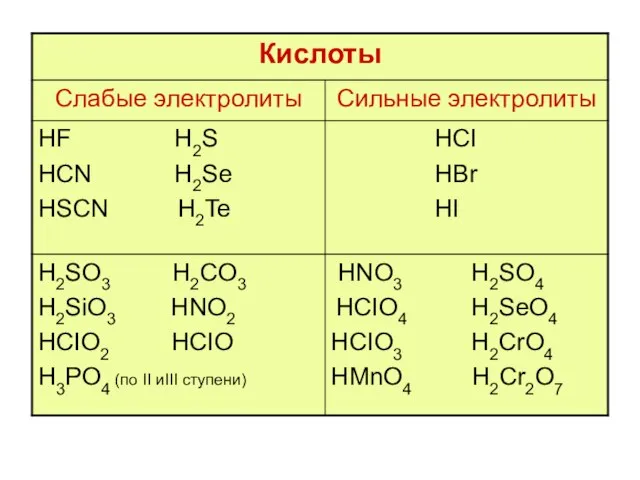
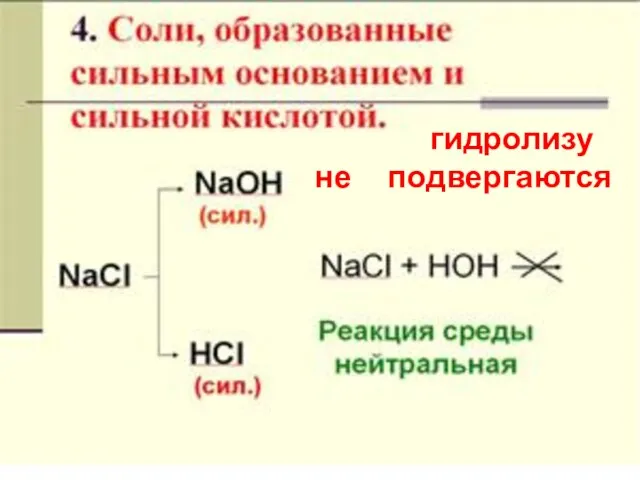
- 23. гидролизу не подвергаются
- 29. Скачать презентацию




 Сера
Сера Теория строения органических соединений
Теория строения органических соединений Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
Электронное и пространственное строение алкенов. Гомология и изомерия алкенов Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Галогены и их соединения
Галогены и их соединения Химико-металлургические методы
Химико-металлургические методы Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Марказит (лучистый колчедан, капельное серебро)
Марказит (лучистый колчедан, капельное серебро) Природные источники углеводородов
Природные источники углеводородов Химическая связь. Строение вещества
Химическая связь. Строение вещества obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Соли. Классификация солей
Соли. Классификация солей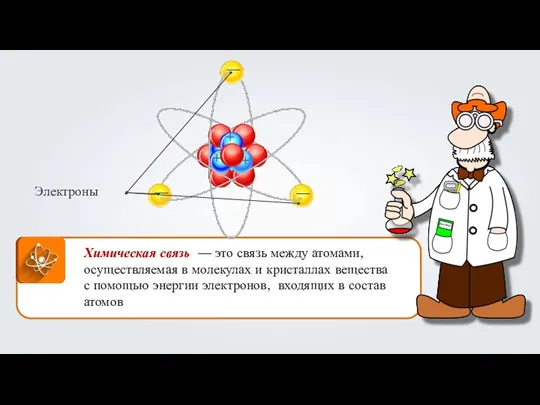 Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Нефть: история и ее применение
Нефть: история и ее применение Адсорбция на границе раствор-газ. ПАВ и ПНАВ
Адсорбция на границе раствор-газ. ПАВ и ПНАВ Относительная молекулярная массa. Химический диктант
Относительная молекулярная массa. Химический диктант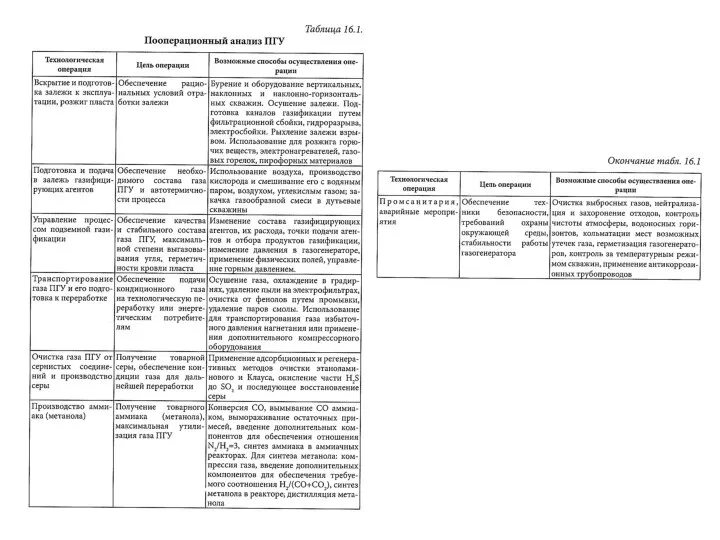 Пооперационный анализ ПГУ
Пооперационный анализ ПГУ Галогены. Обобщение знаний
Галогены. Обобщение знаний Фенол. Классификация фенолов
Фенол. Классификация фенолов Электрическая диссоциация
Электрическая диссоциация 5кл 20.10практична робота
5кл 20.10практична робота Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Выбор материала для изготовления зубчатых колес
Выбор материала для изготовления зубчатых колес Пути использования активной уксусной кислоты
Пути использования активной уксусной кислоты Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Охрана родников Ногликского района и анализ воды из этих родников
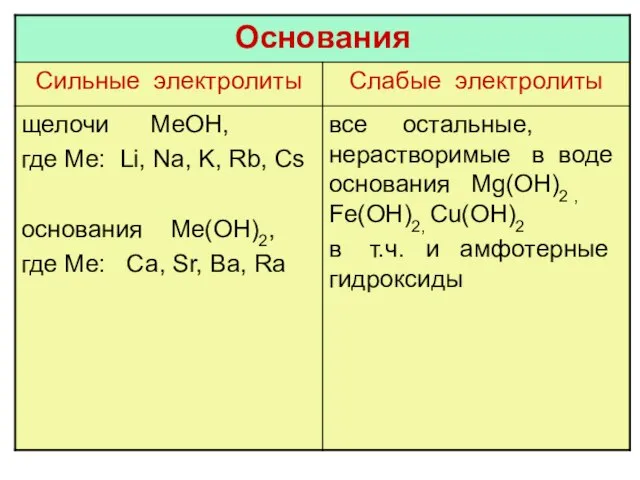
Охрана родников Ногликского района и анализ воды из этих родников Основания. 8 класс
Основания. 8 класс Ð_еÑ_еÑ_огенное Ñ_авн (1)
Ð_еÑ_еÑ_огенное Ñ_авн (1)