Содержание
- 2. Ряд чисел 2,8,5 соответствует распределению электронов в атоме элемента: 1)азота 2)фтора 3)фосфора 4)хлора
- 3. 2. Ряд чисел, соответствующий распределению электронов по уровням в атоме хлора: 1) 2,8,5 2) 7,8,2 3)
- 4. 3. Сокращённая электронная формула 2S22P5 соответствует атомам : 1)фтора 2)хлора 3)азота 4)фосфора
- 5. 4. 2S22Р3 .Укажите знак химического элемента. 1) Р 2) N 3) As 4) В
- 6. 5. Химический элемент электронная формула которого 1S22S22P63S23P4 1)C 2)О 3)Si 4)S
- 7. 6. Количество валентных электронов у атома элемента с порядковым номером 16: 1)16 2)6 3)8 4)2
- 8. 7. Заряд ядра атома кальция: 1)+2 2)+20 3)+40 4)+4
- 9. 8. Количество нейтронов в атоме железа-56: 1)30 2)26 3)56 4)55
- 10. 9. Количество энергетических уровней в атоме элемента хлор: 1)35 2)17 3)7 4)3
- 11. 10. У элементов азот и фосфор одинаковое количество: 1)электронов 2)валентных электронов 3)протонов 4)энергетических уровней
- 12. 11. У элементов алюминий и фосфор одинаковое количество: 1)электронов 2)валентных электронов 3)протонов 4)энергетических уровней
- 14. Свойства атомов
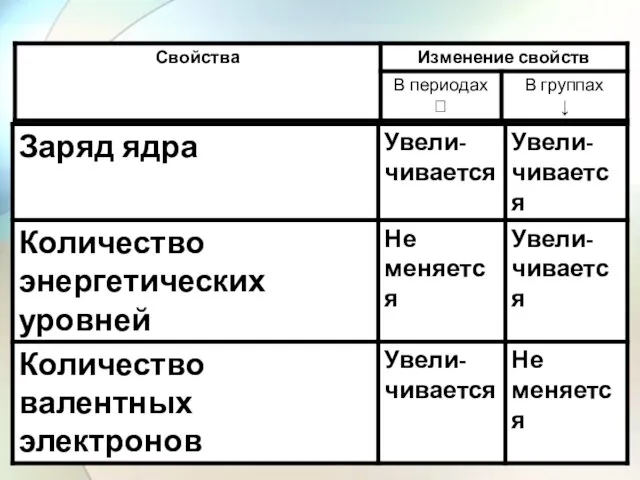
- 15. РАДИУС АТОМА Расстояние между ядрами атомов
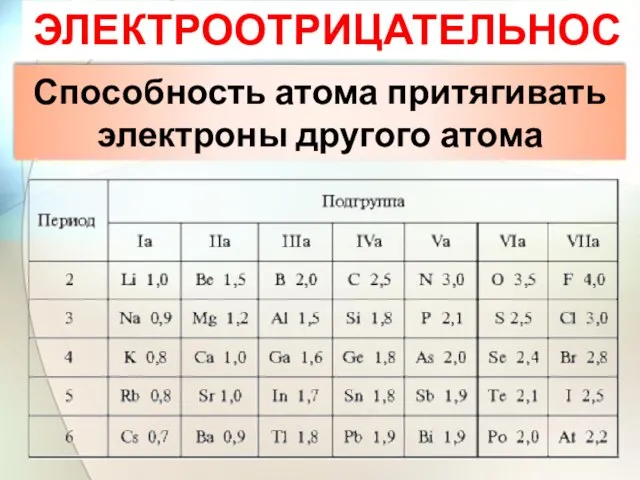
- 16. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ Способность атома притягивать электроны другого атома
- 17. Металлические свойства Способность атома отдавать электроны
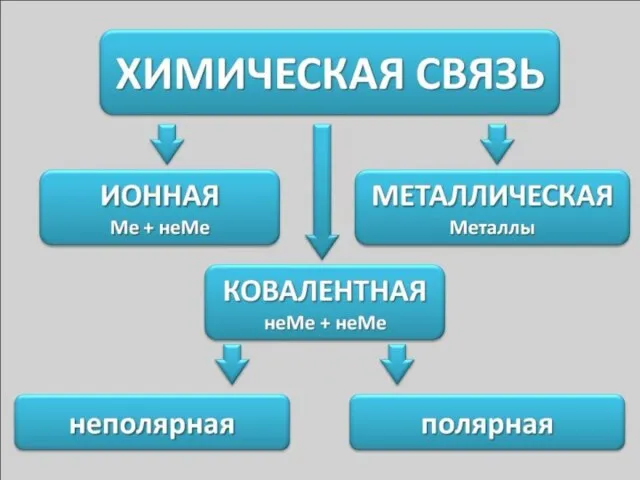
- 20. Связь атомов
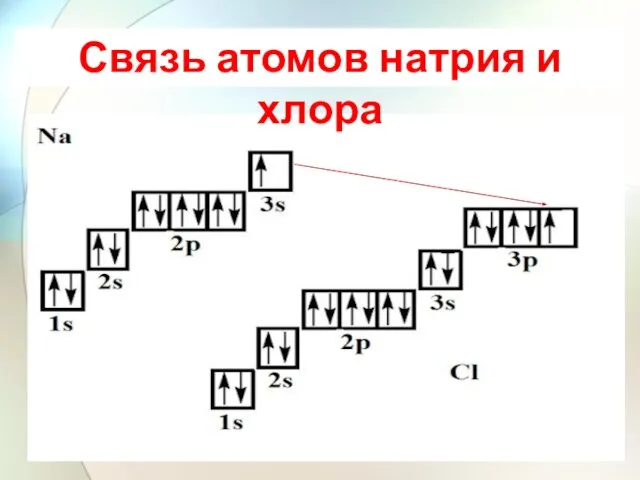
- 22. Связь атомов натрия и хлора
- 23. Связь атомов водорода и фтора
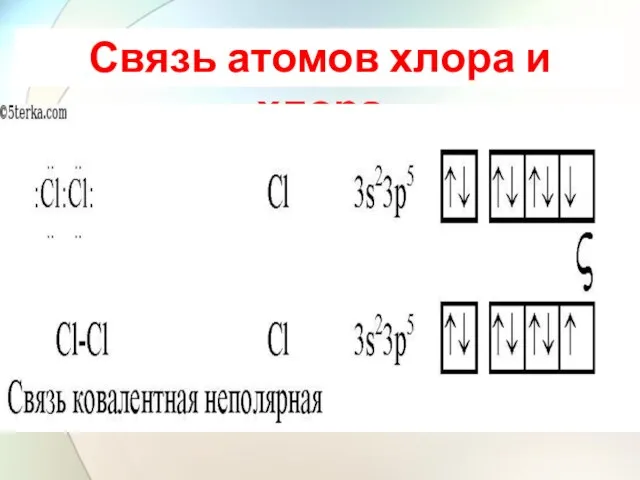
- 24. Связь атомов хлора и хлора
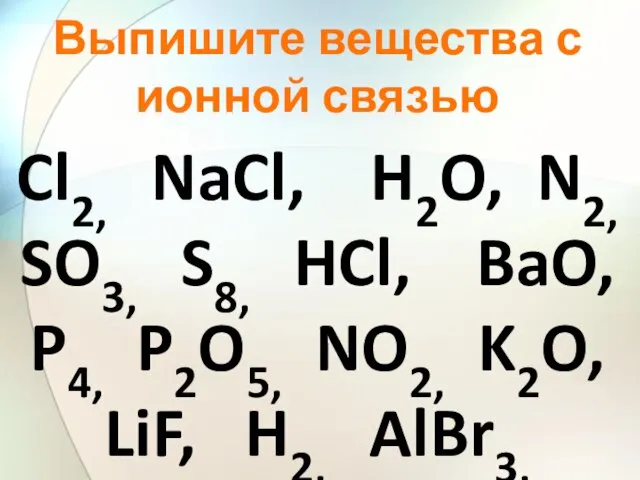
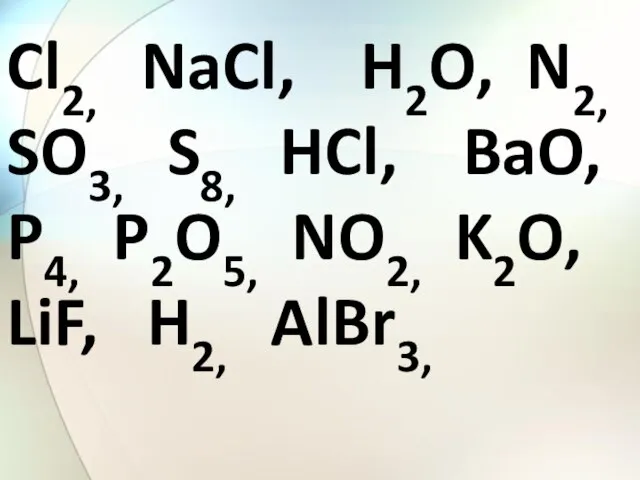
- 26. Cl2, NaCl, H2O, N2, SO3, S8, HCl, BaO, P4, P2O5, NO2, K2O, LiF, H2, AlBr3, Выпишите
- 27. NaCl, BaO, K2O, LiF, AlBr3 Выпишите вещества с ионной связью
- 28. Ковалентная связь – это химическая связь, возникающая за счёт образования общих электронных пар. Общая электронная пара
- 29. Ковалентной неполярной связью (КНПС) называется связь, которая возникает между одинаковыми элементами-неметаллами, т.е. элементами с одинаковыми эо.
- 30. Ковалентной полярной связью (КПС) называется связь, которая возникает между разными элементами-неметаллами, т.е. элементами с отличающимися ЭО.
- 31. Закрепление изученного
- 32. Cl2, NaCl, H2O, N2, SO3, S8, HCl, BaO, P4, P2O5, NO2, K2O, LiF, H2, AlBr3,
- 34. Скачать презентацию
























 Опис технологічного процесу отримання смол бекелітових рідких марок
Опис технологічного процесу отримання смол бекелітових рідких марок Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Ксантановая камедь
Ксантановая камедь Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов
Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов Алюминий
Алюминий Svins. Iegūšana
Svins. Iegūšana Нефть и основные продукты её переработки
Нефть и основные продукты её переработки Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Основы строения и свойства материалов
Основы строения и свойства материалов Алканы. Строение, номенклатура, изомерия, физические свойства
Алканы. Строение, номенклатура, изомерия, физические свойства Углерод и его соединения
Углерод и его соединения Реакционная способность органических соединений
Реакционная способность органических соединений Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Полимерные материалы и изделия
Полимерные материалы и изделия Основные законы химии
Основные законы химии Презентация на тему Биологические действия радиации
Презентация на тему Биологические действия радиации  Презентация на тему Галогены в организме человека
Презентация на тему Галогены в организме человека  Виды металлов, сплавы металлов, применение в промышленности и в быту
Виды металлов, сплавы металлов, применение в промышленности и в быту Щелочные металлы
Щелочные металлы Valentnost
Valentnost Соли. Формула соли
Соли. Формула соли Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Урок №10 12 класс
Урок №10 12 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Природный газ
Природный газ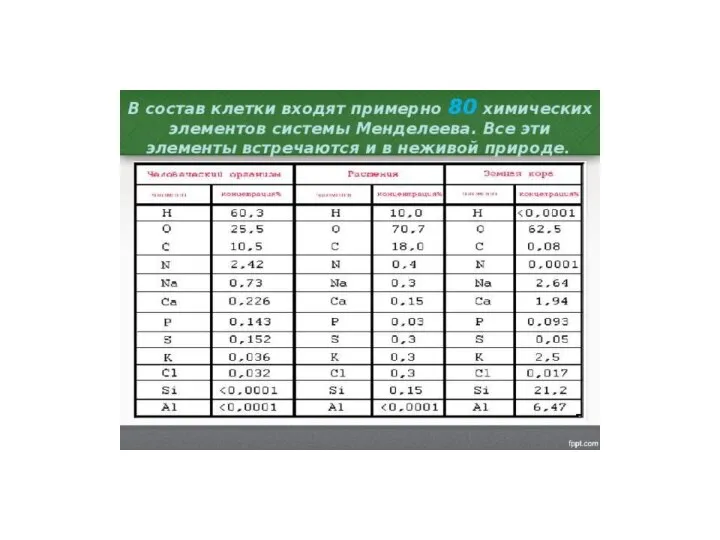 Состав клетки
Состав клетки