Слайд 2Тема 1 : Строение электронных оболочек атомов. Электронная формула и конфигурация
Электронная

оболочка ( энергетический уровень) – это совокупность электронов, близких по значению энергии.
Число электронных оболочек у атома химического элемента равна номеру периода (n), в котором находится химический элемент.
Максимальное число электронов на уровне (N) = 2n2( степень)
Слайд 3Строение электронных оболочек атомов. Электронная формула и конфигурация
Первый период – одна

оболочка , 2 электрона
Второй период – две оболочки , 8 электронов
Третий период- три оболочки , 18 электронов.
Число электронов на внешней оболочке ( на внешнем энергетическом уровне ) определяется номером группы, в которой находится хим. элемент ( больше 8 не может быть. ПОЧЕМУ?)
Слайд 4Энергетические уровни
Завершенные
Незавершенные

Слайд 5Электронная орбиталь ( энергетический подуровень)
- это область пространства вокруг ядра атома

хим. Элемента в которой наиболее вероятно находится электрон
Слайд 7Распределение электронов по орбиталям
1. s- орбитали заполняются в первую очередь .

2. на каждой орбитали ( клеточке) может находиться не более 2электронов.
3. электрон обозначается стрелочками
4. На каждой орбитали могут находится не более двух электронов , спины ( направленность ) их противоположны. ( ПРИНЦИП ПАУЛИ)
Слайд 8Распределение электронов по орбиталям
5. орбитали заполняются электронами так, чтобы их суммарный

спин был максимальным.
Слайд 9Порядок заполнения орбиталей
ЭНЕРГИЯ ОРБИТАЛЕЙ УВЕЛИЧИВАЕТСЯ:
1s<2s<2p<3s<3p<4s~3d<4p<5s~4d<5p<6s~5d~4f<6p

Слайд 10Тема 2. Валентность химических элементов.
Валентность – это способность атомов удерживать при

себе определенное число атомов других элементов.
Валентность – способность атомов химических элементов образовывать определенное число химических связей.
I I I I
НСl H2O NH3 CH4
Валентность атома водорода принята за единицу.
Слайд 11Валентность химических элементов.
Валентность обозначается римской цифрой , которая ставится над знаком

химического элемента в формуле вещества.
II II II
H2O SO3 CO2
Атом кислорода всегда двухвалентен
Слайд 12Валентность химических элементов.
Атомы одних химических элементов имеют постоянную валентность, а других

переменную (т.е. в разных соединениях один и тот же элемент может проявлять разную валентность):
VI IV II
SO3 SO2 H2S
Слайд 13Правила определения валентности элементов в соединениях:
1. Записать химическую формулу вещества и указать

валентность известного элемента.
У Ме , находящихся в главных подгруппах , валентность равна номеру группы. (это 1-3 группа).
У НеМе в основном проявляются две валетности: высшая и низшая.
Например, оксид углерода (IV) имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II
II
СО2
Слайд 14Правила определения валентности элементов в соединениях:
2. Найти наименьшее общее кратное (НОК) между

известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
Слайд 15Правила определения валентности элементов в соединениях:
3. Наименьшее общее кратное разделить на индекс

другого элемента, полученное число и есть значение валентности.
Индекс при атоме углерода равен 1, значит:
4 : 1 = IV – это и есть валентность атома углерода
IV II
СО2
Слайд 16Разберем еще один пример
II
Fe2O3
1. Валентность кислорода постоянна и равна II.
2. НОК:

3 × II = 6
3. 6 : 2 = III – это и есть валентность атома железа
III II
Fe2O3
Слайд 17ДЗ
Определим валентность химических элементов в следующих соединениях:
СаО ZnCl2
N2O3 Li2S
NH3 Mg3P2

Слайд 18
Правила составления химических формул по валентности:
1. Записать химические знаки элементов, входящих в

состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl..O..
Слайд 19Правила составления химических формул по валентности:
Валентность кислорода равна двум, валентность алюминия постоянна,

находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl..O..
Слайд 20Правила составления химических формул по валентности:
2. Определить НОК чисел, обозначающих валентность обоих

элементов.
НОК – наименьшее из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел.
НОК II и III – 6
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
III II
Аl2O3
Слайд 21Пример
Соединение серы с водородом, при чем валентность серы указана, так как

сера имеет переменную валентность.
II
Н..S..
1.Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т.е. индекс при атоме водорода равен 2
4. Записываем формулу с учетом индексов: Н2S ( валентность указать)
Слайд 22Тема 3. Простые вещества-металлы.Физические свойства.
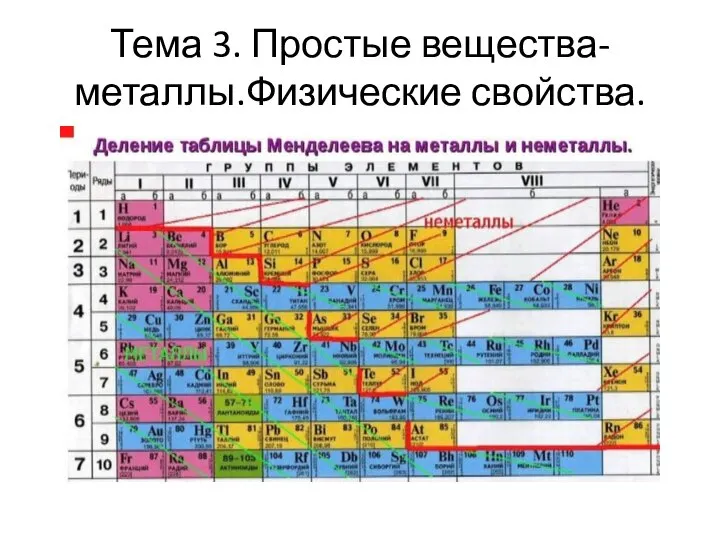
Слайд 23Как отличить Ме от НеМе по ПСХЭ
Проводим диагональную линию от Be

к At, элементы которые находятся выше этой линии НеМе.
Элементы у которых на внешнем энергетическом уровне есть 1-3 электрона относятся к Ме.
Слайд 24Запишите с помощью знаков упомянутые химические элементы
Семь металлов создал свет
По числу семи

планет:
Медь, железо, серебро…
Дал нам Космос на добро.
Злато, олово, свинец…
Сын мой, сера – их отец.
А еще ты должен знать
Всем им ртуть – родная мать.
Слайд 25Исключите лишний химический элемент
Cu, Fe, Ag, Au, Sn, Pb, S, Hg
Это сера-

а почему? Сера-это неметалл.
Сделать Электронные и электронно- графические формулы для следующих элементов: Cu, Fe, Ag, Au, Sn, Pb, S, Hg
Слайд 26Физические свойства
Ковкие
Пластичные
Тягучие
Имеют металлический блеск ( Почему?)
Тепло- и

электропроводны. ( почему ?)
Слайд 27Физические свойства
Самым пластичным из драгоценных металлов является золото.
Все металлы, кроме ртути

( жидкий блестящий серебристо-белый металл) твердые
Ме различаются по твердости:
Мягкие – щелочные металлы ( 1 группа)
Твердые – Сr, Ti, Mo





























 минералы_5_спайность
минералы_5_спайность Игра Самый умный химик
Игра Самый умный химик Строение атома
Строение атома Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Ионные двигатели
Ионные двигатели Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Получение аминов
Получение аминов Обобщение металлов
Обобщение металлов Полиэтилен-1
Полиэтилен-1 Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Презентация на тему Степень окисления (8 класс)
Презентация на тему Степень окисления (8 класс)  Амины. Классификация аминов
Амины. Классификация аминов Растворы
Растворы Азот, соединения азота
Азот, соединения азота Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Презентация по Химии "Ароматы и чем они «пахнут»"
Презентация по Химии "Ароматы и чем они «пахнут»"  Уксусная кислота
Уксусная кислота Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс)  Химические реакции. Вещество
Химические реакции. Вещество Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Воздух
Воздух Презентация на тему Углеводороды (10 класс)
Презентация на тему Углеводороды (10 класс)  Азотная кислота и ее свойства
Азотная кислота и ее свойства Презентация на тему Алхимики
Презентация на тему Алхимики  Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Химические структуры
Химические структуры Консерванты, их виды и применение
Консерванты, их виды и применение