Содержание
- 2. ХИМИЧЕСКАЯ СВЯЗЬ И КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ. Химическая связь — явление взаимодействия атомов.
- 3. ХИМИЧЕСКАЯ СВЯЗЬ В ВЕЩЕСТВАХ
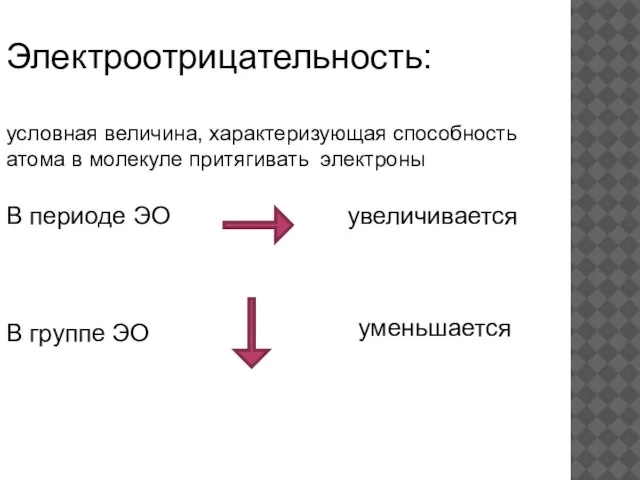
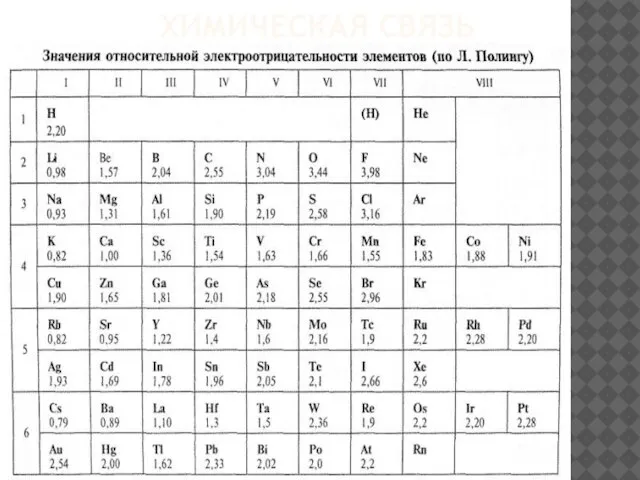
- 4. Электроотрицательность: условная величина, характеризующая способность атома в молекуле притягивать электроны В периоде ЭО увеличивается В группе
- 5. ХИМИЧЕСКАЯ СВЯЗЬ
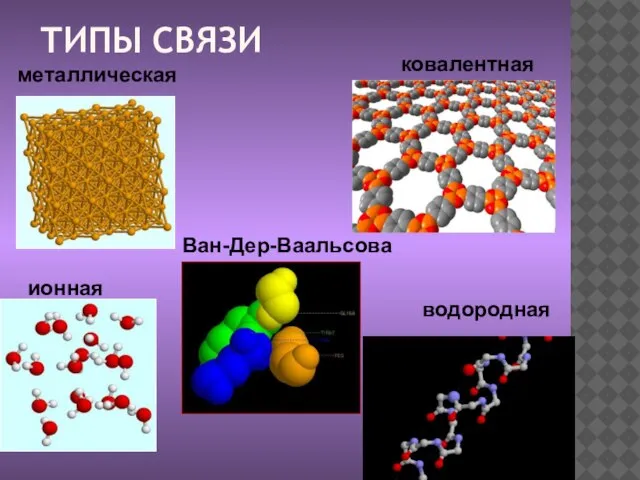
- 6. ТИПЫ СВЯЗИ металлическая ковалентная ионная Ван-Дер-Ваальсова водородная
- 7. Определение типа связи по разности ЭО элементов в соединении: ∆ ЭО 0 ковалентная неполярная связь ∆
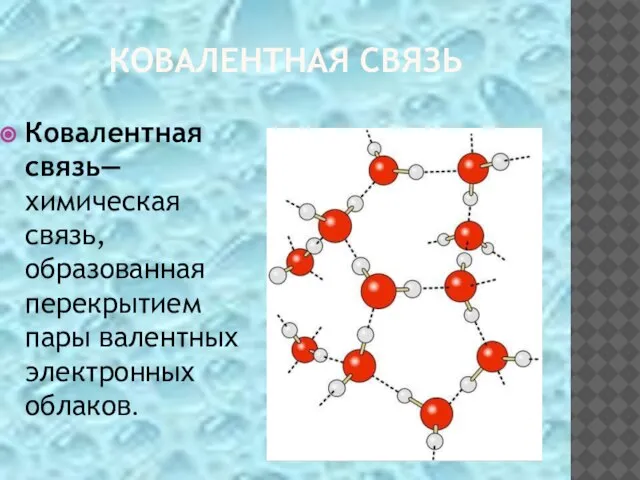
- 8. КОВАЛЕНТНАЯ СВЯЗЬ Ковалентная связь— химическая связь, образованная перекрытием пары валентных электронных облаков.
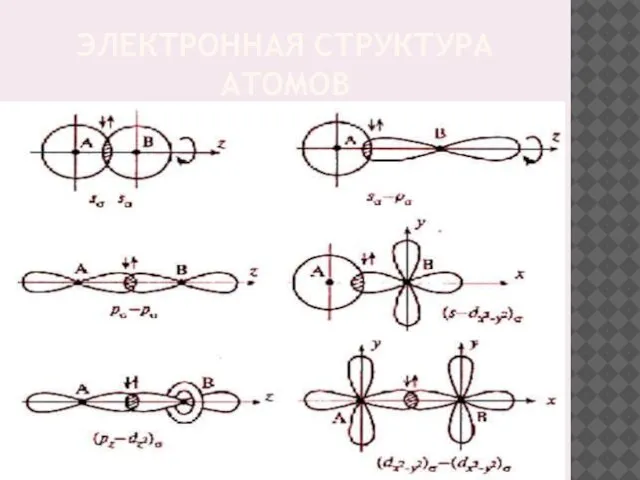
- 9. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ
- 10. ХИМИЧЕСКАЯ СВЯЗЬ
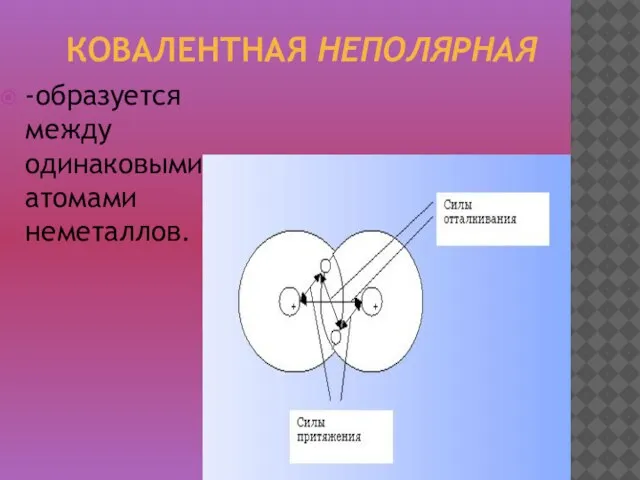
- 11. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -образуется между одинаковыми атомами неметаллов.
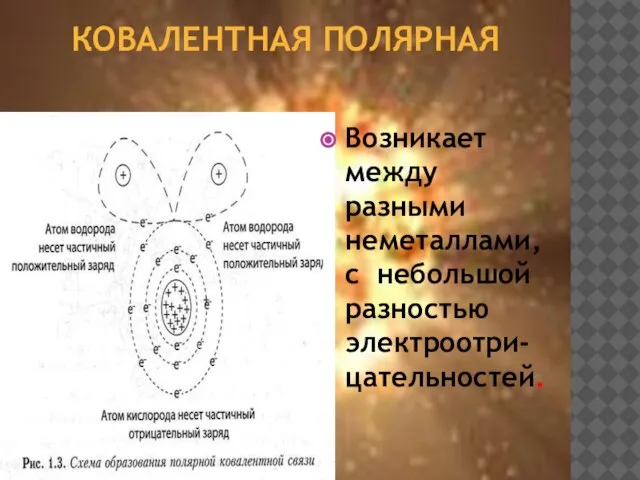
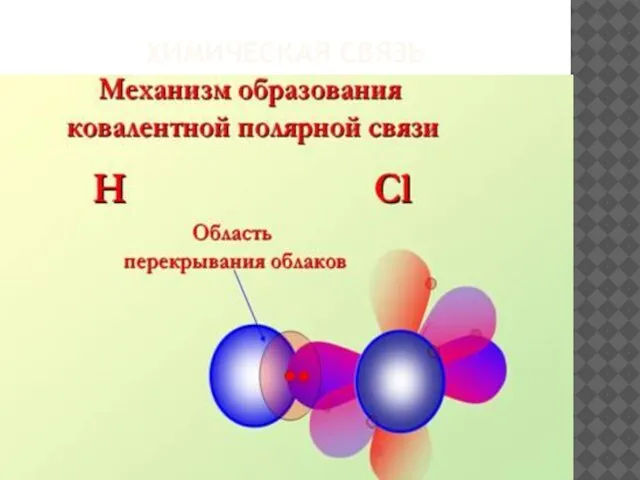
- 12. КОВАЛЕНТНАЯ ПОЛЯРНАЯ Возникает между разными неметаллами, с небольшой разностью электроотри-цательностей.
- 13. ХИМИЧЕСКАЯ СВЯЗЬ
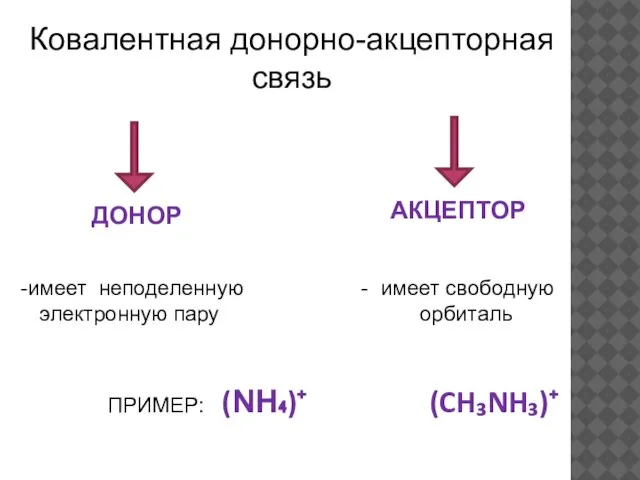
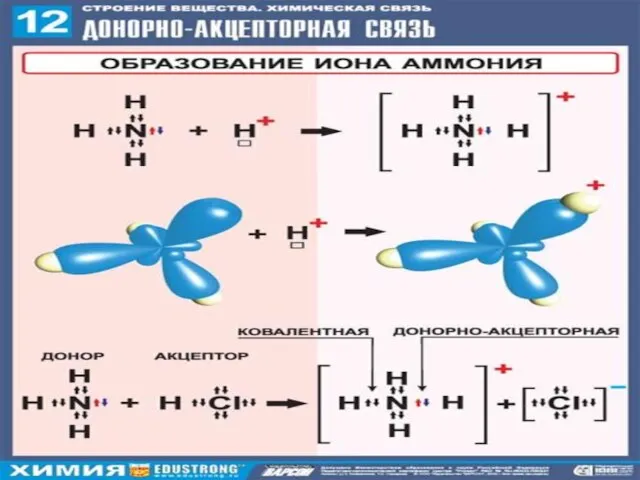
- 14. Ковалентная донорно-акцепторная связь ДОНОР АКЦЕПТОР имеет неподеленную - имеет свободную электронную пару орбиталь ПРИМЕР: (NH₄)⁺ (CH₃NH₃)⁺
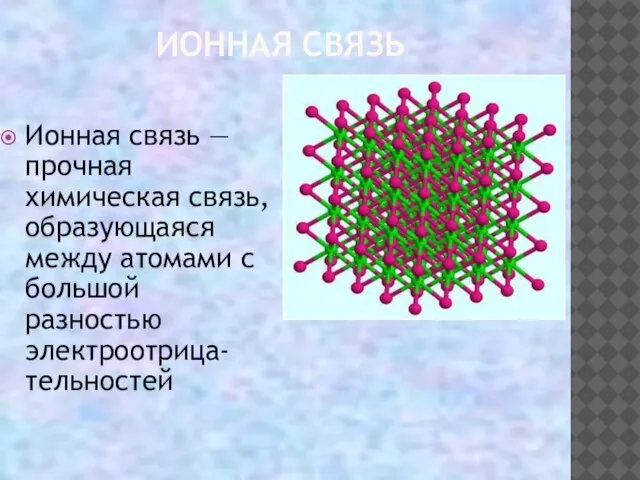
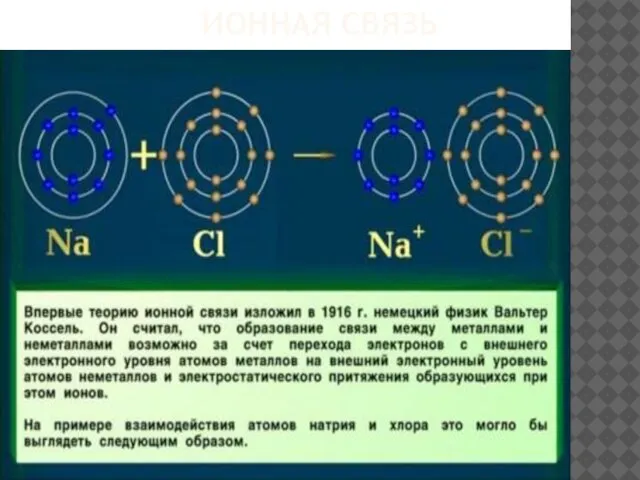
- 16. ИОННАЯ СВЯЗЬ Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрица-тельностей
- 17. ИОННАЯ СВЯЗЬ
- 18. СТЕПЕНЬ ОКИСЛЕНИЯ Сте́пень окисле́ния ( формальный заряд) — условная численная величина электрического заряда, приписываемого атому в
- 19. СТЕПЕНЬ ОКИСЛЕНИЯ Алгоритм определения степени окисления: Найдите элемент(-ты) с постоянной степенью окисления ( постоянная валентность; таблицы
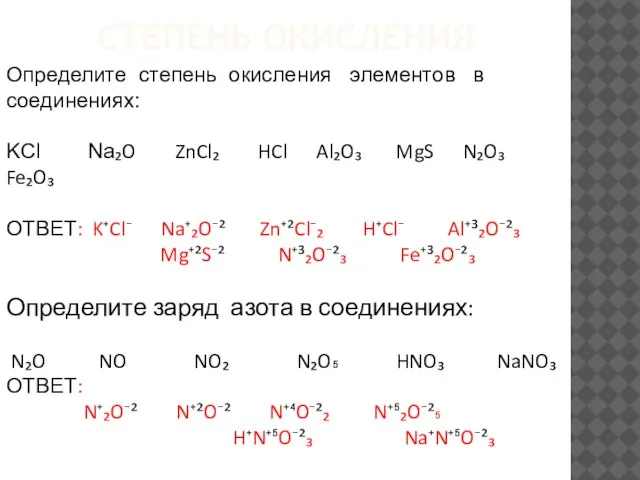
- 20. СТЕПЕНЬ ОКИСЛЕНИЯ Определите степень окисления элементов в соединениях: KCl Na₂O ZnCl₂ HCl Al₂O₃ MgS N₂O₃ Fe₂O₃
- 21. Определите степень окисления марганца в соединениях: MnO Mn₂O₅ MnCl₂ HMnO₄ K₂MnO₄ MnO₂ ОТВЕТ: Mn⁺²O⁻² Mn⁺⁵₂O⁻²₅ Mn⁺²Cl⁻₂
- 22. Определите вид химической связи в соединениях: Cl₂ , H₂O , CO , OF₂ , H₂ ,
- 24. Скачать презентацию







 Химия, химия, химия!
Химия, химия, химия! Классификация, хранение, маркировка химических реактивов
Классификация, хранение, маркировка химических реактивов Влияние меди на коррозию низколегиованных сталей
Влияние меди на коррозию низколегиованных сталей Щелочноземельные металлы
Щелочноземельные металлы Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Температура точки росы газа
Температура точки росы газа Презентация на тему Строение атома
Презентация на тему Строение атома  Презентация Щелочные металлы
Презентация Щелочные металлы Коррозия металлов
Коррозия металлов Классификация неорганических веществ
Классификация неорганических веществ Соли, их классификация и свойства
Соли, их классификация и свойства Химическая связь
Химическая связь Кинетика и равновесие. Лекция №3
Кинетика и равновесие. Лекция №3 Природные и искусственные материалы. Естествознание. 6 класс
Природные и искусственные материалы. Естествознание. 6 класс Олимпиадная подготовка
Олимпиадная подготовка Химическая связь
Химическая связь Известная и неизвестная вода
Известная и неизвестная вода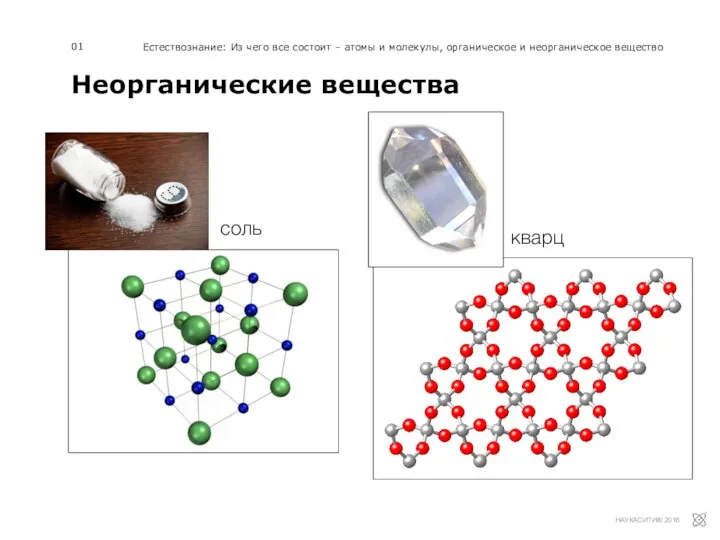 Неорганические вещества
Неорганические вещества Нефть - черное золото
Нефть - черное золото Плотность веществ. Задачи
Плотность веществ. Задачи Общая химическая технология. Определение размеров реакторов. Практическое занятие 8
Общая химическая технология. Определение размеров реакторов. Практическое занятие 8 Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) задачи
задачи Подбор условий определения примесей вБИС-[3(3,5-ДИ-ТРЕТ-БУТИЛ-4
Подбор условий определения примесей вБИС-[3(3,5-ДИ-ТРЕТ-БУТИЛ-4 Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень
Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень