Содержание
- 2. 1-Е ПОЛОЖЕНИЕ ТЭД. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты
- 3. ВЕЩЕСТВА В РАСТВОРАХ Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 4. ЗАДАНИЯ К I-МУ ПОЛОЖЕНИЮ ТЭД Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам:
- 5. II-Е ПОЛОЖЕНИЕ ТЭД В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ, Т.Е. РАСПАДАЮТСЯ НА ИОНЫ. Ионы – ЭТО ПОЛОЖИТЕЛЬНО ИЛИ
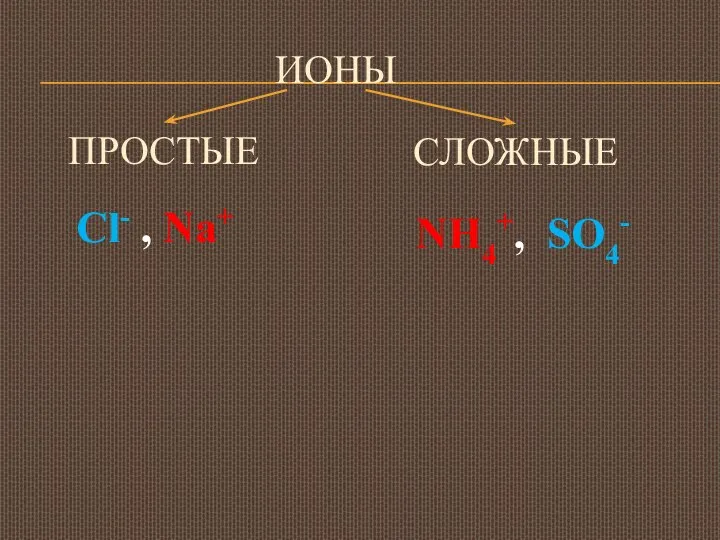
- 6. ИОНЫ ПРОСТЫЕ Сl- , Na+ СЛОЖНЫЕ NH4+, SO4-
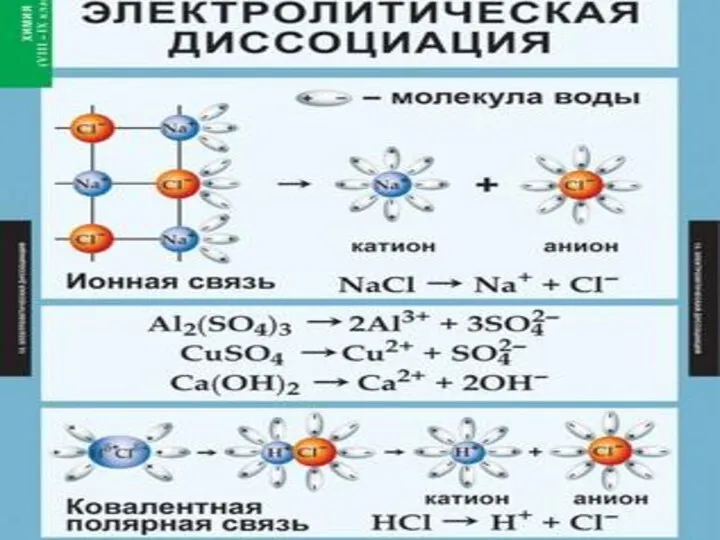
- 7. III-Е ПОЛОЖЕНИЕ ТЭД ПРИЧИНОЙ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА ЯВЛЯЕТСЯ ЕГО ВЗАИМОДЕЙСТВИЕ С МОЛЕКУЛАМИ ВОДЫ (ГИДРАТАЦИЯ). Вещества с ковалентной
- 9. IV-Е ПОЛОЖЕНИЕ ТЭД Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а
- 10. Типы ионов По заряду: положительные, или катионы: Катионы металлов ( Мn+ ) Катион водорода (H+) Катион
- 11. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 12. ЗАДАНИЯ КО II-МУ ПОЛОЖЕНИЮ ТЭД Назовите частицы: а) H, H2 , H+ ; б) Cl2 ,
- 13. V-Е ПОЛОЖЕНИЕ ТЭД Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: Сильные (соли, щелочи,
- 14. VI-Е ПОЛОЖЕНИЕ ТЭД Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По
- 15. ОДНООСНОВНЫЕ КИСЛОТЫ МНОГООСНОВНЫЕ КИСЛОТЫ Диссоциируют в одну ступень HNO3 HNO3 = H+ + NO3- Диссоциируют в
- 16. 2. ОСНОВАНИЯ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ ГИДРОКСОГРУПП ОДНОКИСЛОТНЫЕ ОСНОВАНИЯ МНОГОКИСЛОТНЫЕ
- 17. 3. СОЛИ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ КИСЛОТНОГО ОСТАТКА Независимо от
- 18. ЗАДАНИЕ К 6-МУ ПОЛОЖЕНИЮ Напишите уравнения диссоциации следующих веществ: HCl, H3PO4, KOH
- 20. Скачать презентацию















 Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Ferrum железо
Ferrum железо Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Сера. Немного истории
Сера. Немного истории Соединения алифатического ряда
Соединения алифатического ряда Свойства металлов. Лекция №8
Свойства металлов. Лекция №8 01. Предмет органической химии. ТХСОС А. М. Бутлерова
01. Предмет органической химии. ТХСОС А. М. Бутлерова Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Коррозия металлов
Коррозия металлов Алюминий
Алюминий Типы химических реакций
Типы химических реакций Химическая кинетика и равновесие
Химическая кинетика и равновесие Титан — металл фей
Титан — металл фей Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Строение атома
Строение атома Строение вещества
Строение вещества Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира ТБ_1 (1)
ТБ_1 (1) Периодическая система химических элементов. Дмитрий Иванович Менделеев
Периодическая система химических элементов. Дмитрий Иванович Менделеев Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Именные реакции в органической химии
Именные реакции в органической химии Углерод. Электронная формула
Углерод. Электронная формула Степень окисления
Степень окисления Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Белки
Белки