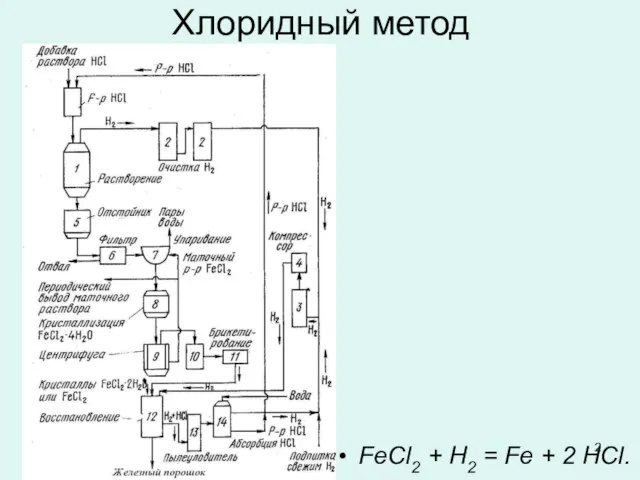
Слайд 2Хлоридный метод
FeCl2 + H2 = Fe + 2 НСl.
Слайд 3Металлотермические методы
МеХ+Ме'= Ме+Ме'Х + Q
МеХ+Ме'H= Mе + Ме'X+HX ±Q
МеХ + Ме'Н
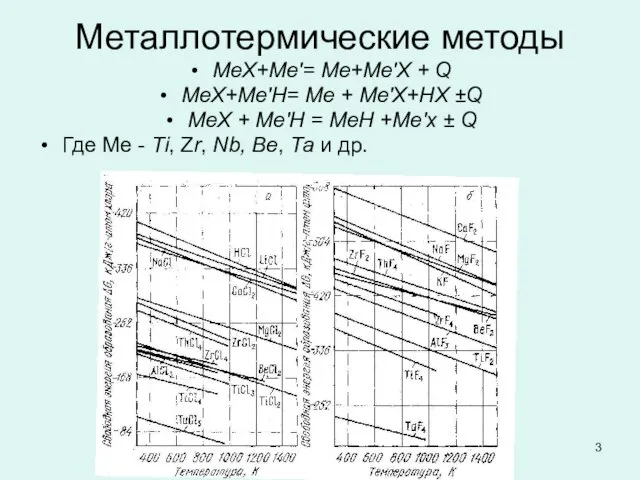
= MеH +Me'x ± Q
Где Ме - Ti, Zr, Nb, Be, Та и др.
Слайд 4Требования к восстановителю
1) металл-восстановитель должен обеспечивать наиболее полное восстановление при возможно меньшем

подводе тепла извне;
2) образующийся шлак, а также избыток восстановителя должны легко отделяться от получаемого металла (путем отмывки, отгонки в вакууме, отшлаковывания);
3) восстановитель должен быть высокой чистоты, чтобы избежать загрязнения получаемого металла примесями;
4) восстановитель должен мало растворяться в получаемом металле и не образовывать с ним устойчивых химических соединений;
5) восстановитель должен быть относительно дешевым и недефицитным.
Слайд 5Восстановление двуокиси титана кальцием
1- реторта;
2 – стальной тигель;
3 – шихта;
4
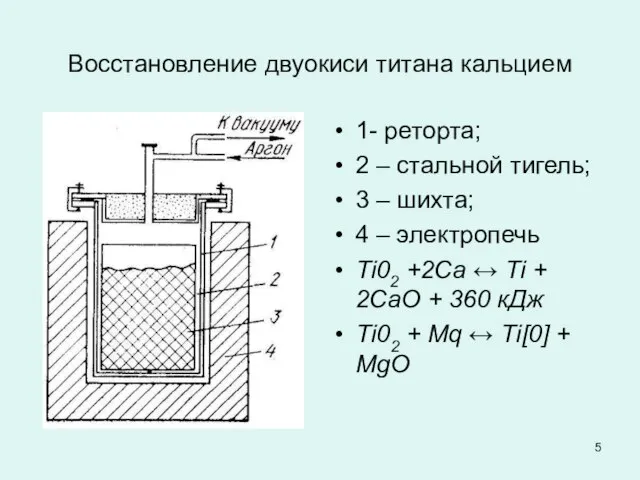
– электропечь
Ti02 +2Са ↔ Ti + 2CаO + 360 кДж
Тi02 + Mq ↔ Тi[0] + МgО
Слайд 6Восстановление диоксида титана и диоксида циркония гидридом кальция
СаН2 — Са +2Н
ZrO2

+ 2СаН2 = ZrH2 + 2CaO + H2
Слайд 7Восстановление хлорида титана натрием
TiCl4 + 4 Naж = Ti + 4
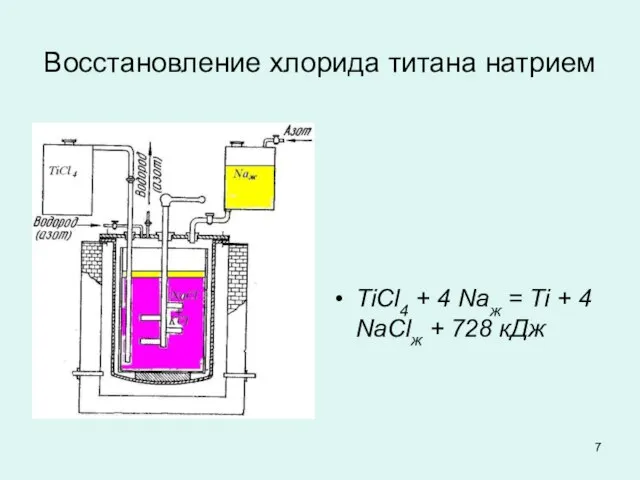
NaClж + 728 кДж
Слайд 8Восстановление четыреххлористого титана магнием
TiCl4(газ) +2Mg(ж) = 2MgCl2(ж) + Ti(т) + 514,3
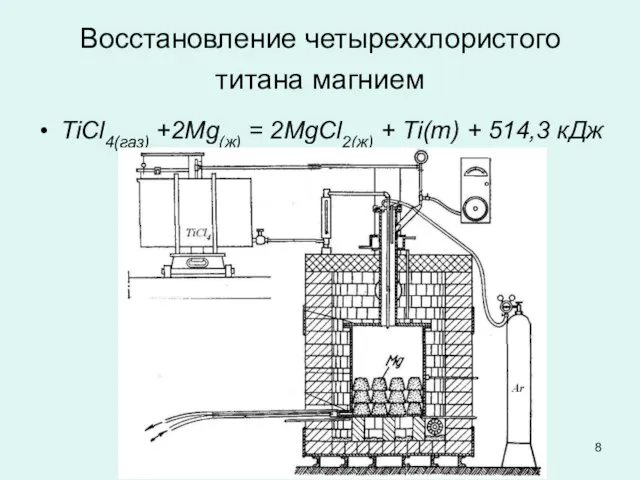
кДж
Слайд 9Восстановление фторотанталата калия натрием
К2ТаF7+ 5Na → Та +5NaF + 2KF +

1500 кДж/моль








 9-8 кислоты в свете ТЭД (1)
9-8 кислоты в свете ТЭД (1) Производство серной кислоты
Производство серной кислоты Карбоциклические соединения. Циклоалканы
Карбоциклические соединения. Циклоалканы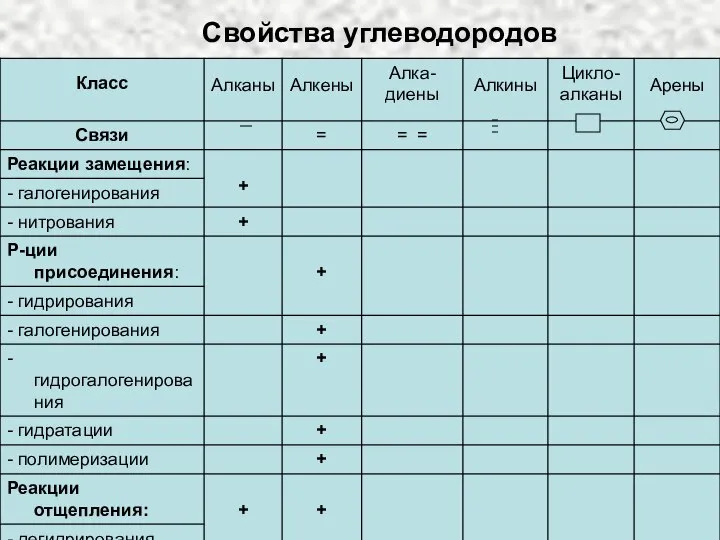 Свойства углеводородов
Свойства углеводородов КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс
КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс Неметаллы. 8 класс
Неметаллы. 8 класс Презентация на тему Стронций
Презентация на тему Стронций  Углеродистые конструкционные стали
Углеродистые конструкционные стали Презентация на тему Дисахариды
Презентация на тему Дисахариды  Лекция 3
Лекция 3 Коррозия металлов
Коррозия металлов Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Метаболизм липидов
Метаболизм липидов Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11
Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11 Металлы II А подгруппы
Металлы II А подгруппы Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Физические и химические явления
Физические и химические явления Химия и нанотехнологии
Химия и нанотехнологии Метаболизм азота
Метаболизм азота Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Электронное строение
Электронное строение Химический состав молока
Химический состав молока Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Химические реакции. Вещество
Химические реакции. Вещество