Содержание
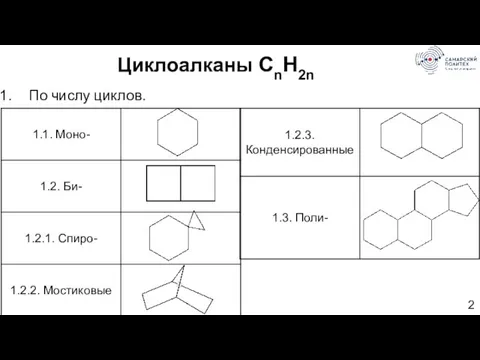
- 2. Циклоалканы CnH2n По числу циклов.
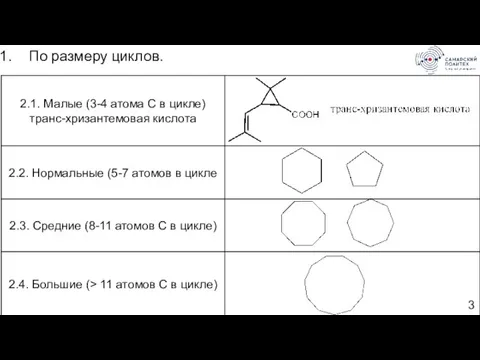
- 3. По размеру циклов.
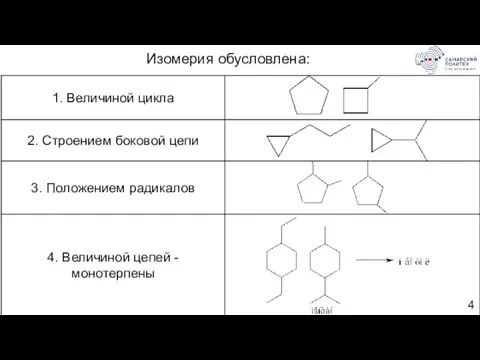
- 4. Изомерия обусловлена:
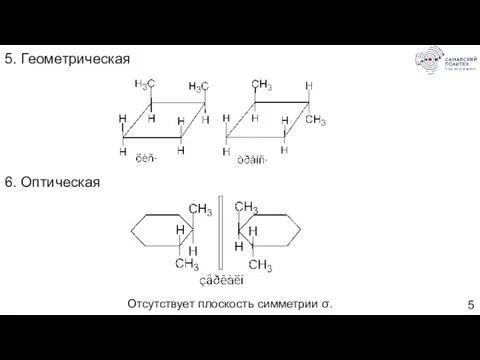
- 5. 5. Геометрическая 6. Оптическая Отсутствует плоскость симметрии σ.
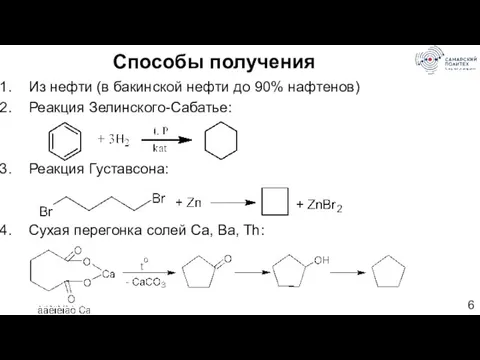
- 6. Способы получения Из нефти (в бакинской нефти до 90% нафтенов) Реакция Зелинского-Сабатье: Реакция Густавсона: Сухая перегонка
- 7. 5. Реакция Перкина-Кижнера: 6. Циклоприсоединение: [2+1] [2+4] Реакция Дильса-Альдера [2+2]
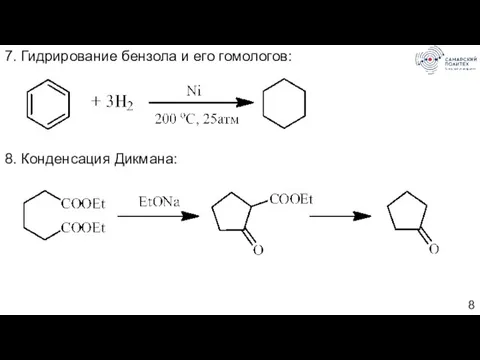
- 8. 7. Гидрирование бензола и его гомологов: 8. Конденсация Дикмана:
- 9. Прочность циклов. Теория напряжения. По теплоте сгорания Напряжение Байера (угловое) – увеличение энергии молекулы, вызванное отклонением
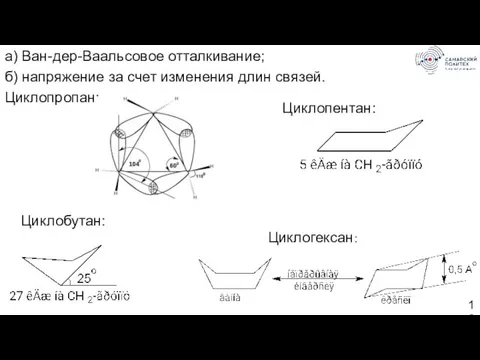
- 10. а) Ван-дер-Ваальсовое отталкивание; б) напряжение за счет изменения длин связей. Циклопропан: Циклобутан: Циклопентан: Циклогексан:
- 11. а- аксиальный заместитель (у такого заместителя связи с атомами С цикла ориентированы параллельно вертикальной оси симметрии
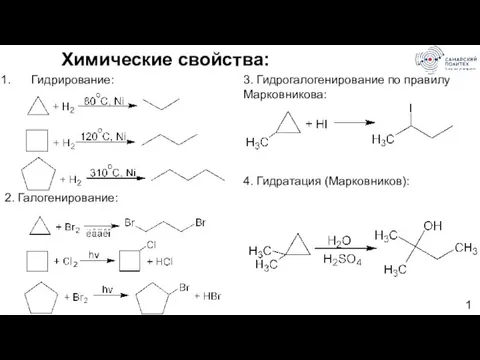
- 12. Химические свойства: Гидрирование: 2. Галогенирование: 3. Гидрогалогенирование по правилу Марковникова: 4. Гидратация (Марковников):
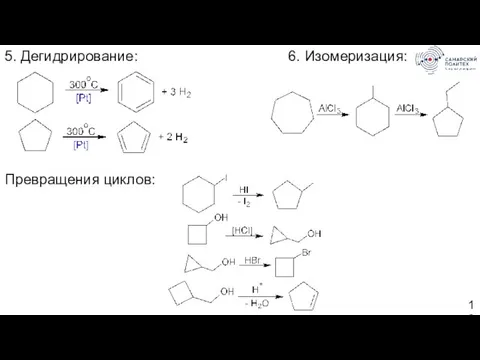
- 13. 5. Дегидрирование: 6. Изомеризация: Превращения циклов:
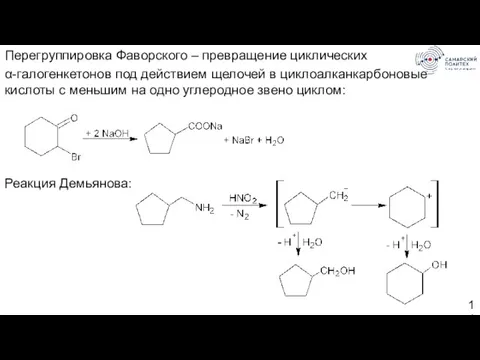
- 14. Перегруппировка Фаворского – превращение циклических α-галогенкетонов под действием щелочей в циклоалканкарбоновые кислоты с меньшим на одно
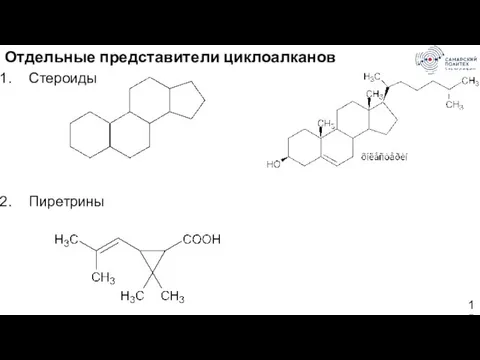
- 15. Отдельные представители циклоалканов Стероиды Пиретрины
- 17. Скачать презентацию
![5. Реакция Перкина-Кижнера: 6. Циклоприсоединение: [2+1] [2+4] Реакция Дильса-Альдера [2+2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/873276/slide-6.jpg)


 Исследование физико-химических свойств щавелевой кислоты
Исследование физико-химических свойств щавелевой кислоты Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Вермикулитовый концентрат
Вермикулитовый концентрат Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Строение атома
Строение атома Aurul, caracteristici, stare
Aurul, caracteristici, stare Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Увлекательный мир химии
Увлекательный мир химии Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1
Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1 Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Строение атомов. Изотопы
Строение атомов. Изотопы Составление ионных уравнений
Составление ионных уравнений Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения! Алкены-2 (электрофильные реакции)
Алкены-2 (электрофильные реакции) Неорганические вещества клетки для дистанта (2)
Неорганические вещества клетки для дистанта (2) Тесты по химии (вопросы)
Тесты по химии (вопросы) ГИА по химии 2010-2011
ГИА по химии 2010-2011 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Альдегиды и кетоны
Альдегиды и кетоны Металлы. Тест с ответами
Металлы. Тест с ответами Презентация по Химии "Алмаз и графит"
Презентация по Химии "Алмаз и графит"  Контрольная работа
Контрольная работа Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Химия в игре. Проектная работа
Химия в игре. Проектная работа Химическая связь
Химическая связь