Содержание
- 2. НЕМЕТАЛЛЫ - химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими и химическими
- 3. Физические свойства неметаллов: Неметаллы находятся в разных агрегатных состояниях: Агрегатное состояние Газы Жидкости Твердые вещества
- 4. Газообразные вещества неметаллы N2 Не О2 - Ne H2 - Ar Cl2 - Kr F2 -
- 5. Твердые вещества: S P I2 C Si сера фосфор йод углерод Si - кремний
- 6. Жидкое вещество: бром
- 7. Физические свойства Не имеют металлического блеска(искл. крист. Йод и графит); Хрупкие в твердом состоянии; не обладают
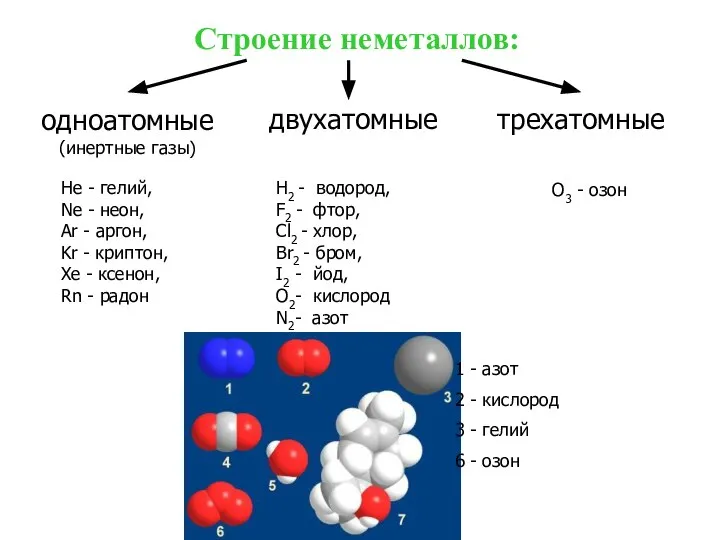
- 8. O3 - озон Строение неметаллов: одноатомные (инертные газы) двухатомные трехатомные He - гелий, Ne - неон,
- 9. АЛЛОТРОПИЯ Способность атомов одного химического элемента образовывать несколько простых веществ.
- 10. Причины аллотропии: Различное число атомов в молекуле; Образование различных кристаллических форм.
- 11. Аллотропия кислорода. Кислород и озон
- 12. Модификации кислорода. О2- кислород; бесцветный газ; не имеет запаха; плохо растворим в воде; температура кипения-182,9 С;
- 13. Аллотропия фосфора. Красный и белый фосфор Р (красный фосфор) (белый фосфор) Р4
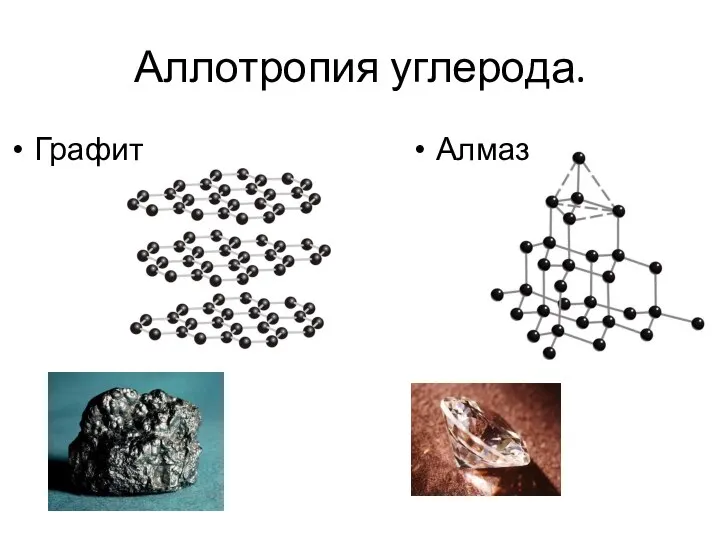
- 14. Аллотропия углерода. Графит Алмаз
- 15. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 17. Скачать презентацию












 Соли Na2SO4
Соли Na2SO4 Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Презентация на тему Галогены
Презентация на тему Галогены  Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Строение атома
Строение атома Планетарная модель атома и его строение
Планетарная модель атома и его строение Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Кислоты и соли
Кислоты и соли Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Триметилалюминий
Триметилалюминий Биотит и тальк
Биотит и тальк Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Строение органических соединений
Строение органических соединений Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Альдегиды и кетоны
Альдегиды и кетоны Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Сера и ее соединения
Сера и ее соединения Белки
Белки Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота