Содержание
- 2. Karboksüülhapped – карбоновые кислоты Rasvhapped - жирные кислоты Aminohapped - аминокислоты Kaksikioon – биполярный ион Piptiidside
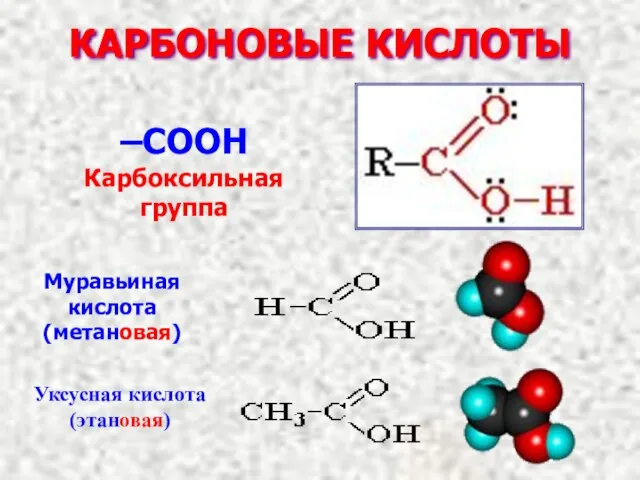
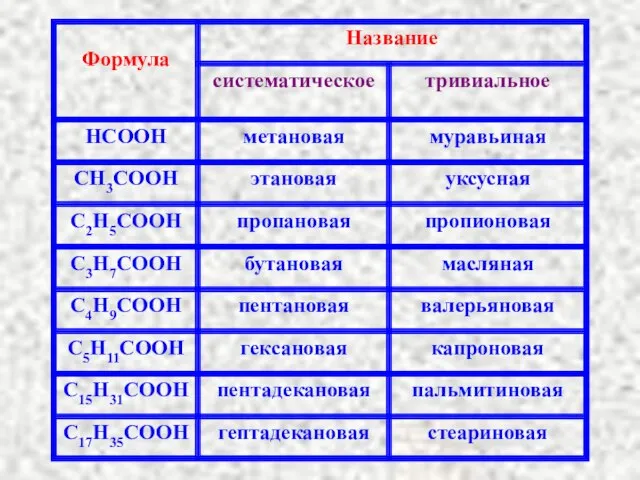
- 3. КАРБОНОВЫЕ КИСЛОТЫ –COOH Карбоксильная группа
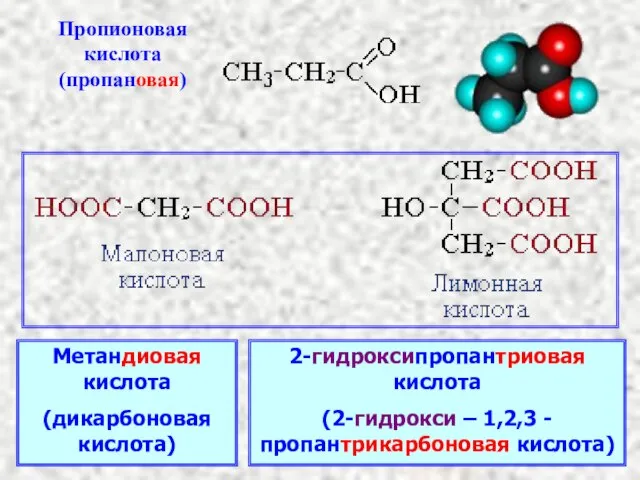
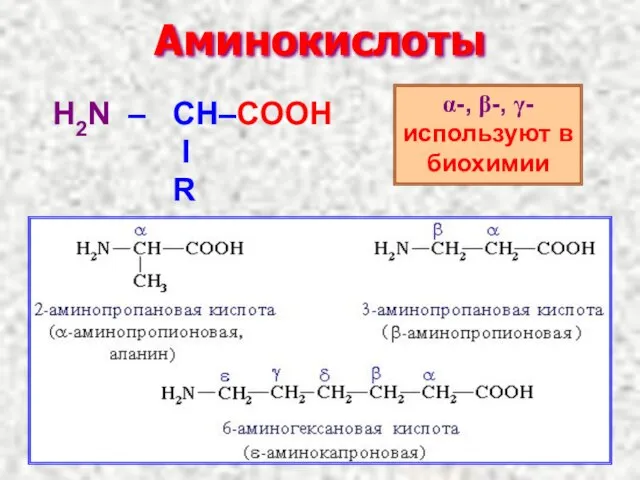
- 4. Метандиовая кислота (дикарбоновая кислота) 2-гидроксипропантриовая кислота (2-гидрокси – 1,2,3 -пропантрикарбоновая кислота)
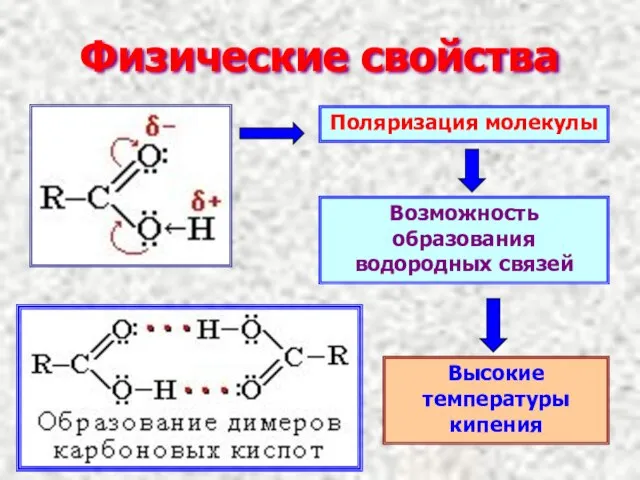
- 6. Физические свойства Поляризация молекулы Возможность образования водородных связей Высокие температуры кипения
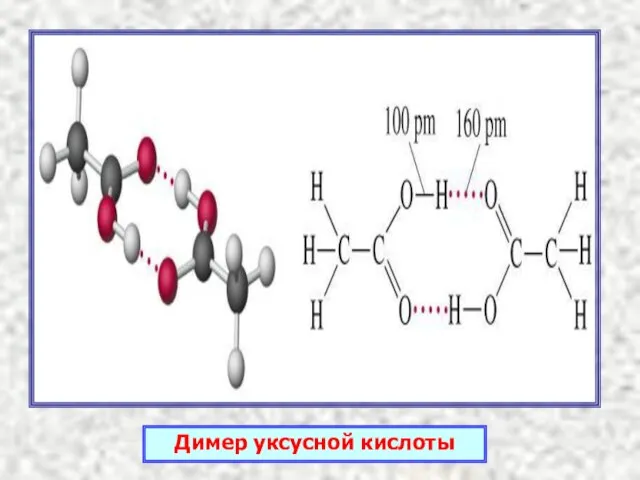
- 7. Димер уксусной кислоты
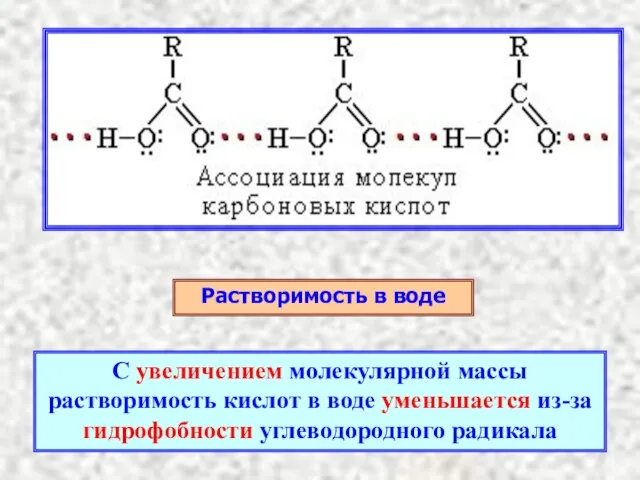
- 8. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
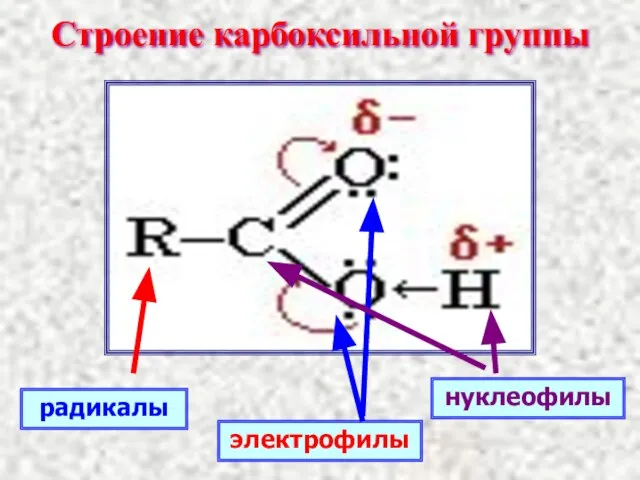
- 9. Строение карбоксильной группы радикалы нуклеофилы электрофилы
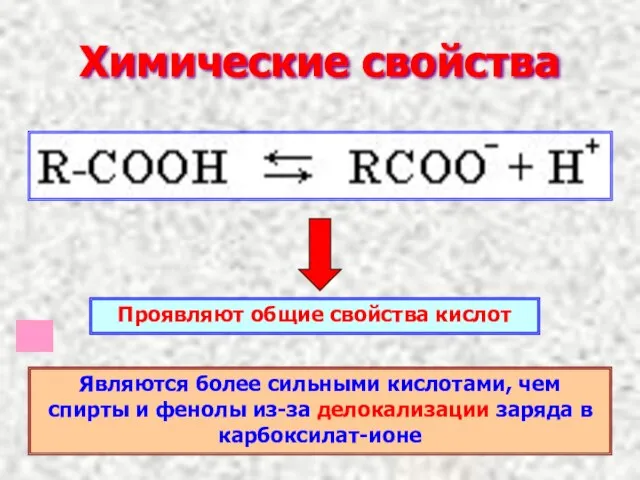
- 10. Химические свойства Проявляют общие свойства кислот Являются более сильными кислотами, чем спирты и фенолы из-за делокализации
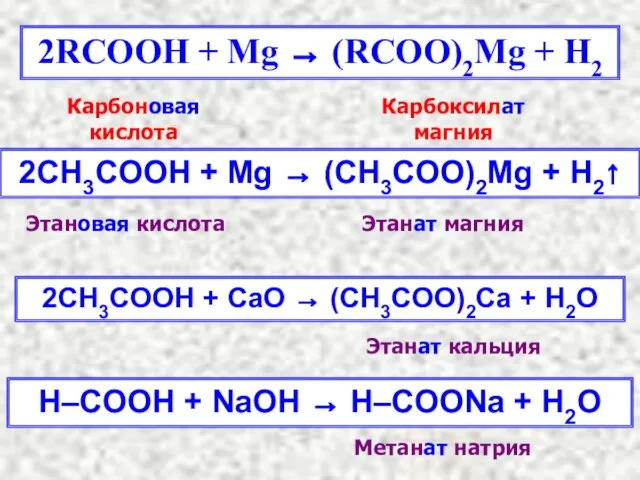
- 11. 2RCOOH + Mg → (RCOO)2Mg + H2 2СH3COOH + Mg → (CH3COO)2Mg + H2↑ Карбоновая кислота
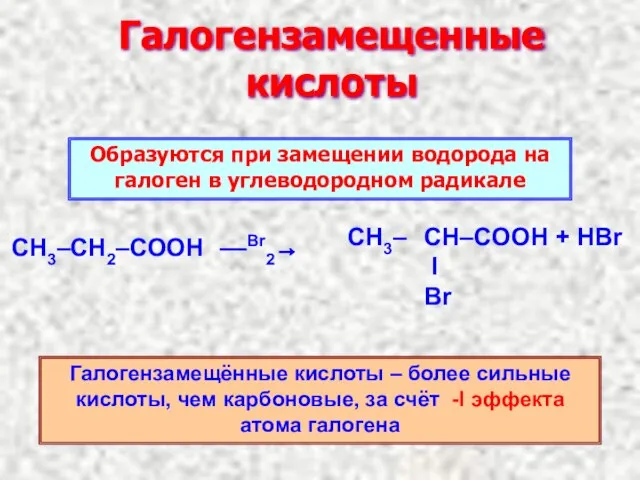
- 12. Галогензамещенные кислоты ––Br2→ Образуются при замещении водорода на галоген в углеводородном радикале Галогензамещённые кислоты – более
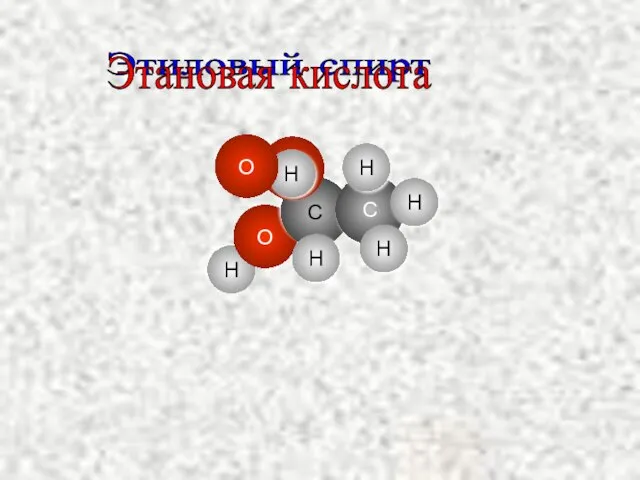
- 13. H O C O C H H H Этиловый спирт H H Этановая кислота O
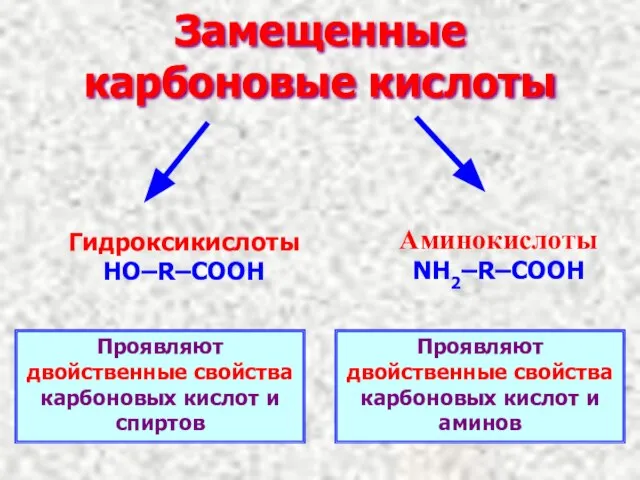
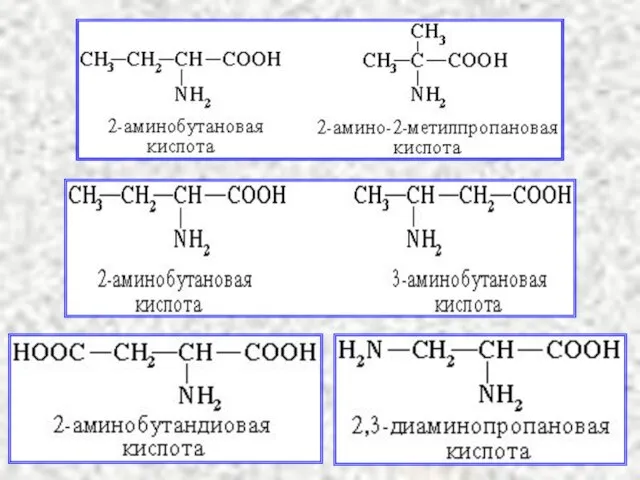
- 14. Замещенные карбоновые кислоты Гидроксикислоты HO–R–COOH Аминокислоты NH2–R–COOH Проявляют двойственные свойства карбоновых кислот и спиртов Проявляют двойственные
- 15. Аминокислоты α-, β-, γ- используют в биохимии
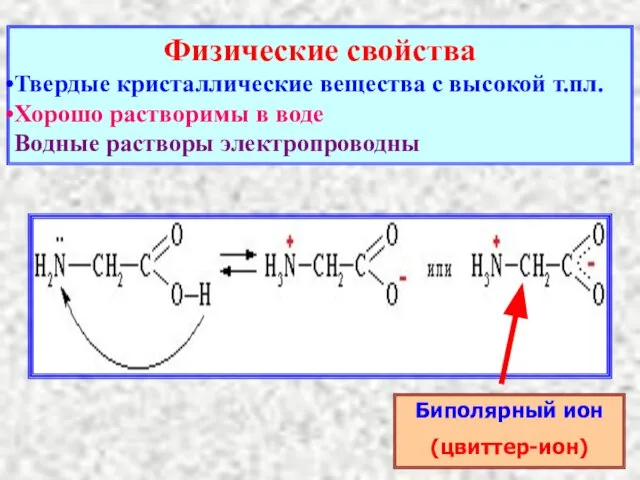
- 17. Физические свойства Твердые кристаллические вещества с высокой т.пл. Хорошо растворимы в воде Водные растворы электропроводны Биполярный
- 18. Химические свойства Аминокислоты являются амфотерными соединениями H2N–CH2–COOH + HCl → Cl− [H3N–CH2–COOH]+ Как основание H2N–CH2–COOH +
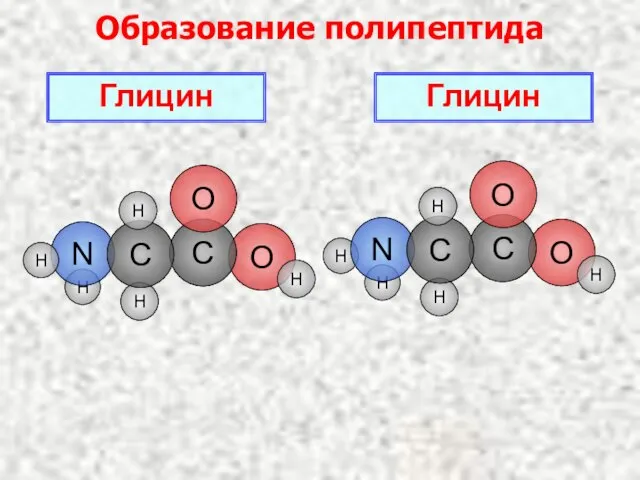
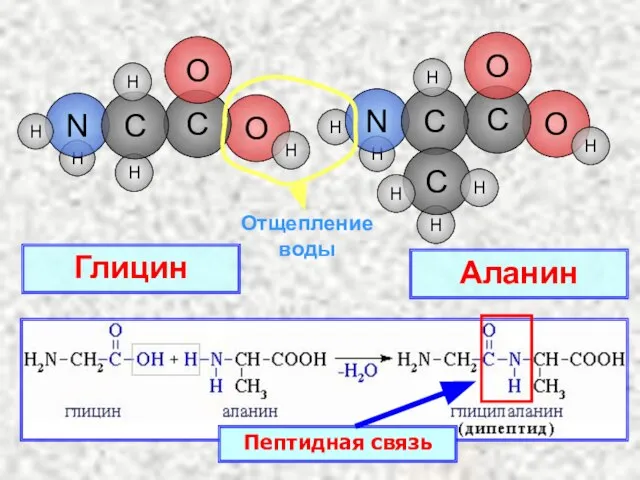
- 19. Образование полипептида Глицин H O H H Глицин
- 20. H O H H H H O C N O C H H C H H
- 22. Скачать презентацию

![Химические свойства Аминокислоты являются амфотерными соединениями H2N–CH2–COOH + HCl → Cl− [H3N–CH2–COOH]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/480101/slide-17.jpg)
 Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Распределение электронов в атоме по энергетическим уровням
Распределение электронов в атоме по энергетическим уровням Скорость химических реакций
Скорость химических реакций Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Генетический ряд переходного элемента
Генетический ряд переходного элемента Предмет органической химии. Теория химического строения органических веществ. 9 класс
Предмет органической химии. Теория химического строения органических веществ. 9 класс Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Коррозия металла
Коррозия металла Строение сложного фермента
Строение сложного фермента Молочная кислота
Молочная кислота Органическая химия Жиры
Органическая химия Жиры Алюминий
Алюминий Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Полімери. Пінополістирол
Полімери. Пінополістирол Изомерия, её виды
Изомерия, её виды Аргентум, или серебро
Аргентум, или серебро Азот
Азот Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Харктеристика металлов
Харктеристика металлов Соли
Соли Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Периодическая система
Периодическая система Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год
Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год Модели молекул
Модели молекул Алкины. Номенклатура алкинов
Алкины. Номенклатура алкинов Алканы
Алканы Основные понятия органической химии
Основные понятия органической химии