Содержание
- 2. Методы получения дисперсных систем
- 3. Диспергирование Преодолевается когезионное сцепление Стадии диспергирования: Объемная (упругая деформация); Образование новой поверхности. По степени измельчения: Дробление
- 4. Диспергирование. Эффект Ребиндера - пропорционален объему, т.е. кубу линейного размера тела d - пропорционален площади поверхности,
- 5. Эффект Ребиндера Примеры эффекта Ребиндера Смазочно-охлаждающие жидкости (СОЖ) – водные эмульсии ПАВ, облегчают обработку резанием Магматические
- 6. Диспергирование Эффективность диспергирования Разрушение материала идет по дефектам. По мере диспергирования количество дефектов уменьшается, прочность частиц
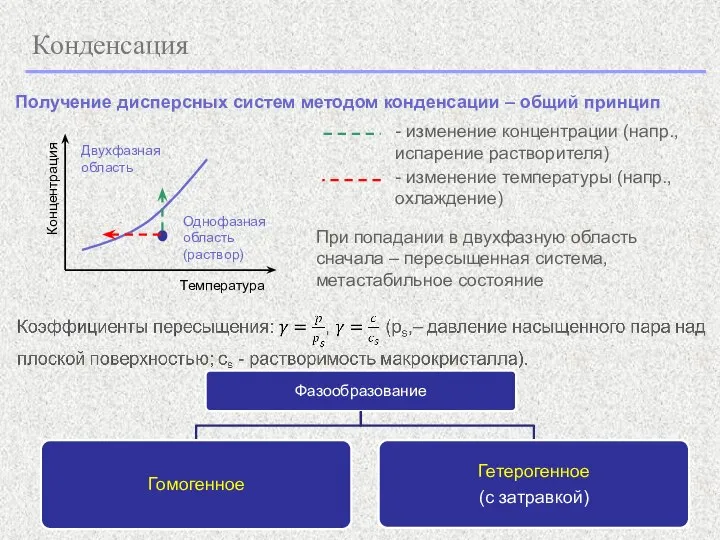
- 7. Конденсация Получение дисперсных систем методом конденсации – общий принцип Температура Концентрация Однофазная область (раствор) Двухфазная область
- 8. Конденсация (1)
- 9. Конденсация - энергия образования зародышей критического размера Добавки ПАВ могут снизить поверхностное натяжение и облегчить фазообразование
- 10. Конденсация
- 11. Конденсация Гетерогенное зародышеобразование Возможные ситуации при гетерогенном зародышеобразовании: Полное несмачивание подложки новой фазой Плохое смачивание подложки
- 12. Конденсация Гетерогенное зародышеобразование
- 13. Конденсация Скорость зародышеобразования Скорость роста кристаллов
- 14. Химическая конденсация Восстановительные реакции 2KAuO2 + 3HCHO + K2CO3 = 2Au + 3HCOOK + KHCO3 +
- 16. Скачать презентацию











 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1) Классификация реакций
Классификация реакций Пидорасня
Пидорасня Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Карбонильные соединения
Карбонильные соединения Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Классы неорганических веществ
Классы неорганических веществ Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Презентация Лекция 2. Химическая кинетика
Презентация Лекция 2. Химическая кинетика Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Презентация на тему Биотехнологии. Генная инженерия
Презентация на тему Биотехнологии. Генная инженерия  Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Современные сплавы на основе циркония
Современные сплавы на основе циркония Жиры
Жиры Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Соли Na2SO4
Соли Na2SO4 Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение