двух и более компонентов.
Растворитель – это составная часть раствора, которая преобладает, не изменяющее своего агрегатного состояния в процессе растворения.
Растворенное вещество присутствует в растворе в меньшем , чем растворитель количестве и может изменять свое агрегатное состояние при растворении.
По физико-химической природе растворенного вещества все растворы подразделяют на 2 большие группы:
1. электролиты- растворы, проводящие электрический ток
2. неэлектролиты –растворы, не способные проводить электрический ток.
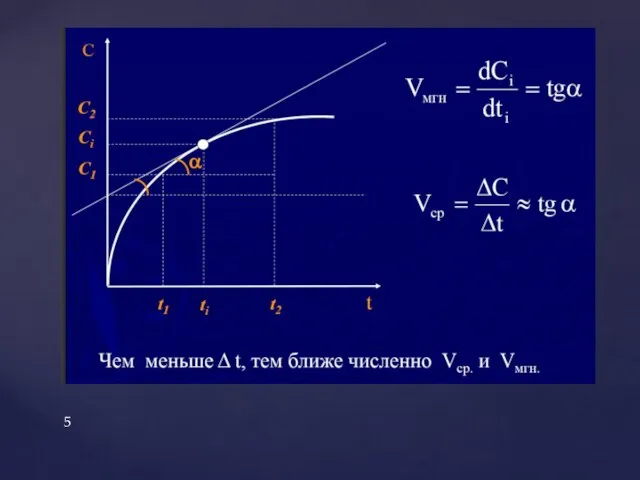
Коллигативные свойства растворов-
свойства, которые определяются только числом растворенных частиц, а не их природой.
К ним относят:
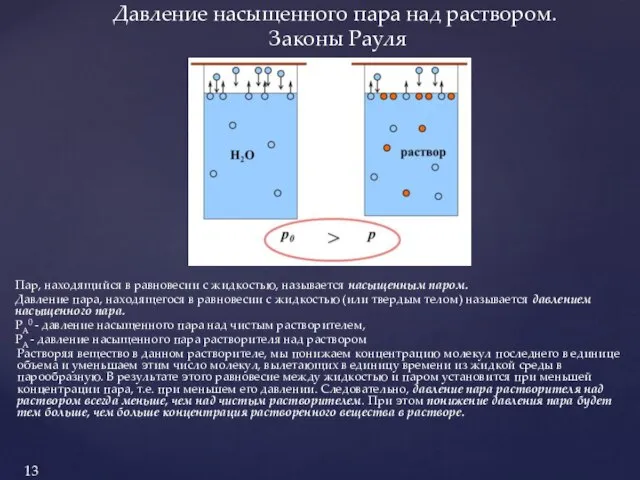
1.Давление пара над раствором
2. Повышение температуры кипения раствора
3. Понижение температуры замерзания раствора
4. Осмотическое давление
РАСТВОРЫ














 Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Использование информационных технологий в образовательном процессе на примере химии
Использование информационных технологий в образовательном процессе на примере химии Кислоты
Кислоты Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Кондуктометрический анализ
Кондуктометрический анализ Уравнение состояния
Уравнение состояния Кислоты органические и неорганически
Кислоты органические и неорганически Комплексные соединения
Комплексные соединения Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Презентация на тему Белки. Строение и свойства
Презентация на тему Белки. Строение и свойства  Кислотно-основное равновесие
Кислотно-основное равновесие Соли в свете теории электролитической диссоциации (ТЭД)
Соли в свете теории электролитической диссоциации (ТЭД) Органические реагенты
Органические реагенты Производство метанола
Производство метанола Презентация на тему Движение электрона в атоме
Презентация на тему Движение электрона в атоме 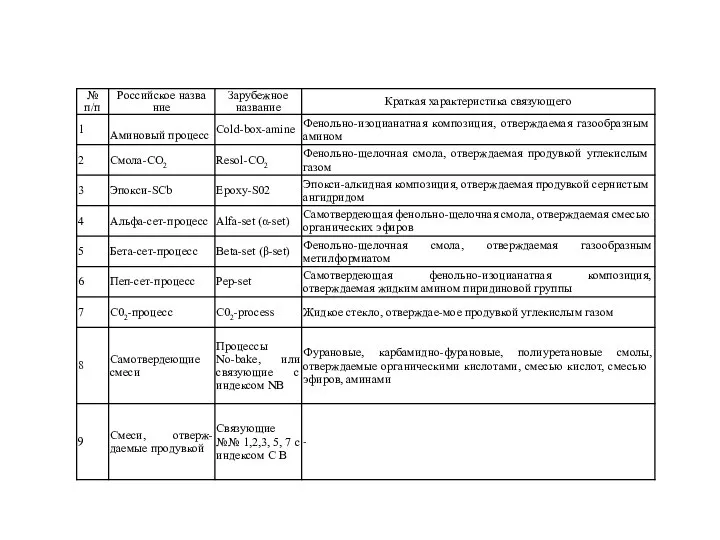 Фенольно-изоцианатная композиция
Фенольно-изоцианатная композиция Презентация на тему Таблица Менделеева внутри нас
Презентация на тему Таблица Менделеева внутри нас  Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения
Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения Каучук
Каучук Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Презентация на тему Чистые вещества и смеси
Презентация на тему Чистые вещества и смеси  Строение молекул. Метод валентных связей. Лекция 5
Строение молекул. Метод валентных связей. Лекция 5 Подготовка к экзамену. Органическая химия
Подготовка к экзамену. Органическая химия Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Виды автомобильного топлива
Виды автомобильного топлива Нефть и способы её переработки
Нефть и способы её переработки Предельные углеводороды
Предельные углеводороды