Содержание
- 2. Виды оксидов азота N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 N2O – оксид
- 3. План 1) Формула оксида 2) Получение 3) Физические свойства 4) Химические свойства 5) Применение
- 4. N2O- оксид азота (I) . 1. Физические свойства Бесцветный газ со слабым запахом и сладковатым вкусом,
- 5. Оксид азота (I) N2O 1.Получение. Разложение нитрата аммония при нагревании: NH4NO3 = N2O + 2H2O Нагрев
- 6. Химические свойства Несолеобразующий оксид( не реагирует с водой, основными оксидами и основаниями) -3 0 +1 +2
- 7. Оксид азота (II) NO Получение. 1. При реакции неактивных металлов с разбавленной азотной кислотой: 3Cu +
- 8. NO-оксид азота (II) Бесцветный газ, не имеет запаха. В воде малорастворим. Термически Окислительно-восстановительная двойственность Восстановитель: 2NO
- 9. Химические свойства. Несолеобразующий оксид Может проявлять и окислительные и восстановительные свойства. 2NO + O2 = 2NO2
- 10. N2O3-оксид азота (III) Жидкость, темно – синего цвета, термически неустойчива, t кип.= 3,5 С, т. е.
- 11. Оксид азота (III) N2O3 Получить можно при сильном охлаждении эквимолярной смеси NO и NO2: NO +
- 12. Оксид азота (IV) «Лисий хвост» Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
- 13. Оксид азота (IV) NO2 Получение. Термическим разложением нитратов металлов, расположенных в ряду активности в интервале Al-Сu:
- 14. Оксид азота (IV) NO2 Химические свойства – кислотный оксид Взаимодействие с водой: 2NO2 + H2O(хол) =
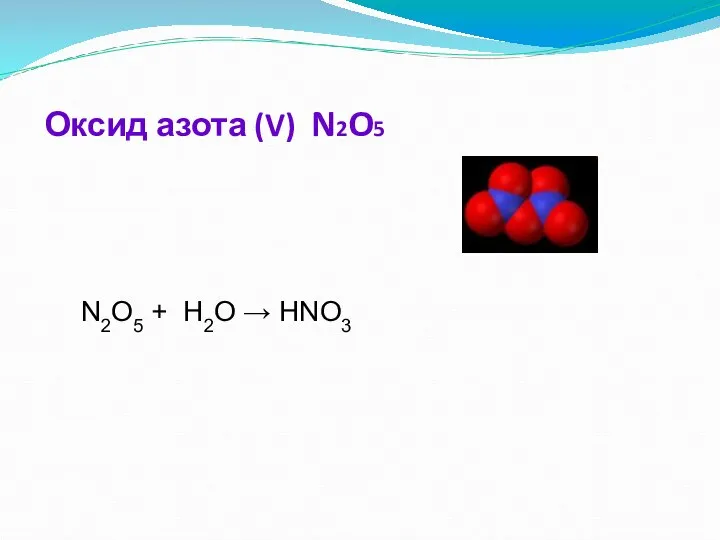
- 15. Оксид азота (V) Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты : N2O5
- 16. Химические свойства. Оксид азота(V) - кислотный оксид. 1. При растворении в воде образует азотную кислоту: N2O5
- 17. Оксид азота (V) N2O5 N2O5 + H2O → HNO3
- 18. Обобщающие задания. 1.Имеются три закрытых цилиндра: с оксидом азота (IV), с азотом, с аммиаком. Как проще
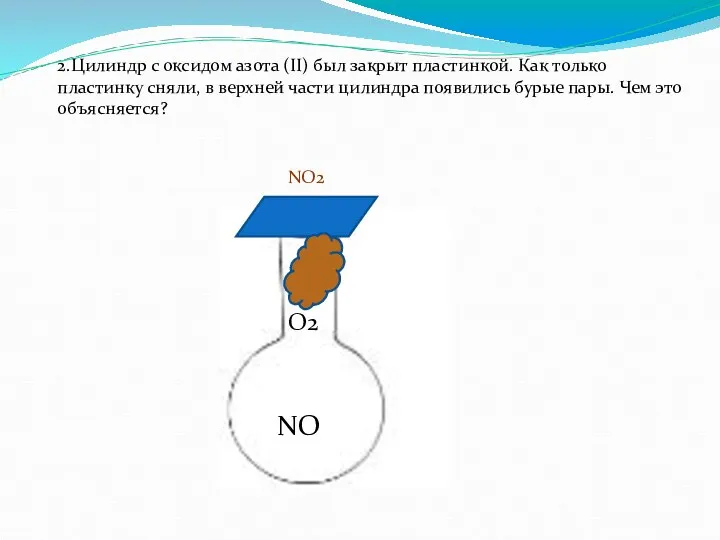
- 19. 2.Цилиндр с оксидом азота (II) был закрыт пластинкой. Как только пластинку сняли, в верхней части цилиндра
- 20. Кислотные дожди
- 21. Влияние кислотных дождей на животных
- 23. Скачать презентацию


















 proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Химические вещества, используемые при пайке
Химические вещества, используемые при пайке Азот, соединения азота
Азот, соединения азота Теория электролитической диссоциации
Теория электролитической диссоциации Топливо и расчеты его горения
Топливо и расчеты его горения Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Способы получения металлов
Способы получения металлов Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ Презентация на тему Кислород
Презентация на тему Кислород  Интрузивные контакты. Контакты интрузивных и осадочных пород
Интрузивные контакты. Контакты интрузивных и осадочных пород Супер-химия. Викторина
Супер-химия. Викторина Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия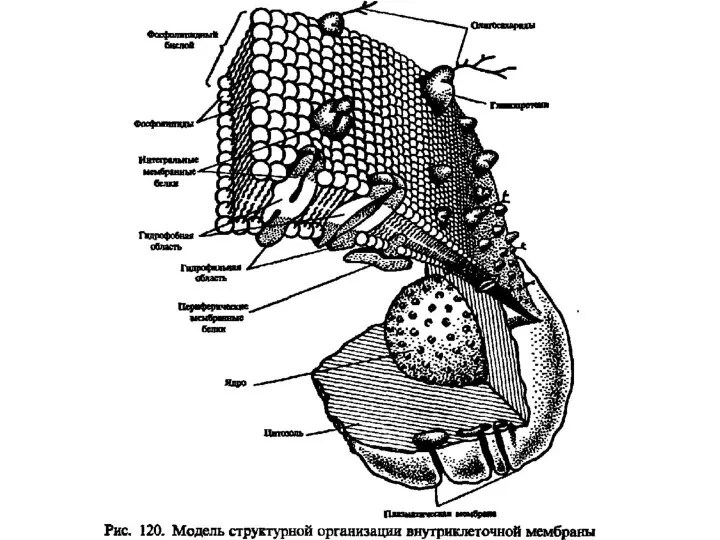 Липиды. Классификация липидов
Липиды. Классификация липидов Белки
Белки Моносахариды
Моносахариды Химическая термодинамика
Химическая термодинамика Элементы vi группы главной подгруппы. Халькогены (рождающие руды)
Элементы vi группы главной подгруппы. Халькогены (рождающие руды) Карбоновые кислоты
Карбоновые кислоты Карбоновые кислоты
Карбоновые кислоты Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Фосфор - светоносный
Фосфор - светоносный Элементарный химический состав белков
Элементарный химический состав белков Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Способы получения металлов
Способы получения металлов Презентация на тему Степень окисления (8 класс)
Презентация на тему Степень окисления (8 класс)