Слайд 2Хроматометрия – (дихроматометрия, устаревшее – бихроматометрия) – один из методов титриметрического химического

анализа для определения восстановителей, а также катионов металлов, образующих малорастворимые хроматы (осадительное титрование).
Слайд 3Метод основан на предварительном восстановлении окислителей до соединений низшей степени окисления и

последующем титровании полученных восстановленных форм стандартным раствором дихромата калия; или окислители восстанавливают стандартным раствором восстановителя (чаще всего ионами Fe2+) с последующим титрованием избытка восстановителя дихроматом.
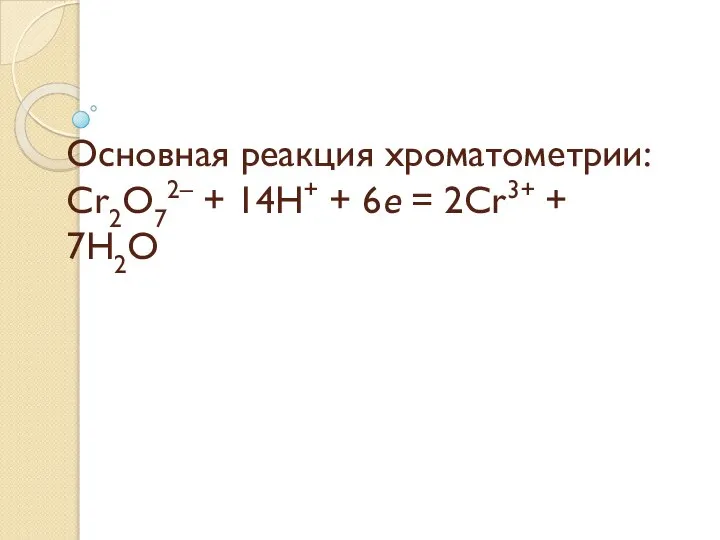
Слайд 4Основная реакция хроматометрии:
Cr2O72– + 14H+ + 6e = 2Cr3+ + 7H2O
Слайд 5Методом хроматометрии можно определять почти те же вещества, что и методом перманганатометрии.

Наиболее широко хроматометрия используется для определения урана, и особенно ― содержания железа в рудах и сплавах. Образцы растворяют в серной или соляной кислотах, при этом железо получается в виде ионов Fe2+ и Fe3+. Хроматометрия используется также для определения ионов, дающих малорастворимые хроматы, например, Ba2+, Pb2+, Ag+.
Слайд 6Достоинства:
1. Перекристаллизацией из водного раствора с последующим высушиванием при 2000С легко получить

химически чистый дихромат калия строго соответствующий формуле K2Cr2O7. Поэтому стандартный раствор дихромата калия готовят по точной его навеске. Полученный раствор можно использовать как для титрования, так и для стандартизации растворов других веществ.
2. Растворы дихромата калия очень устойчивы. Он не разлагается даже при кипячении в подкисленном растворе, поэтому титр раствора не изменяется в течение длительного времени.
3. Титрование дихроматом калия можно проводить в солянокислой среде. При этом на холоде ионы Cl− не окисляются. Однако, при концентрации HCl более 2 н. или при кипячении дихромат калия окисляет ионы Cl− до свободного хлора.
4. Дихромат труднее, чем перманганат восстанавливается органическими веществами, попадающими в дистиллированную воду.





 Нанотехнологии в быту
Нанотехнологии в быту Избранные главы органической стереохимии
Избранные главы органической стереохимии Нефть и её переработка
Нефть и её переработка 8-9-10 химические формулы
8-9-10 химические формулы Применение кислорода
Применение кислорода Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Супер-химия. Викторина
Супер-химия. Викторина Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Галогены
Галогены Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Соли
Соли Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Разложение отходов. 11 класс
Разложение отходов. 11 класс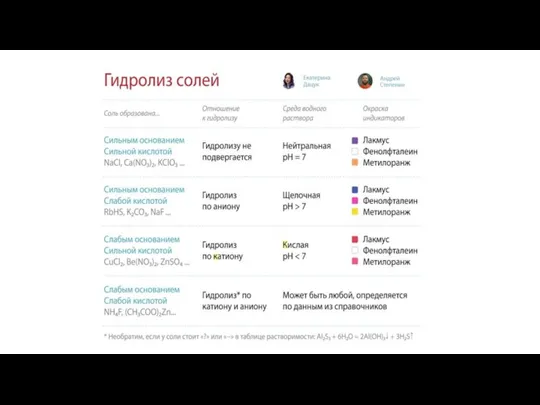 Гидролиз солей
Гидролиз солей Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Фепромарон. Химическое название
Фепромарон. Химическое название Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Ионы. Катионы и анионы
Ионы. Катионы и анионы Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии
Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии Реакция полимеризации
Реакция полимеризации Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Химия в быту
Химия в быту Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты