Содержание
- 2. «Ядерная физика и технологии», «Физика материалов и процессов», «Ядерная физика и космофизика», «Ядерная медицина» «Физика элементарных
- 3. 1часть: Основы теории химии электронное строение атома и химическая связь химическая термодинамика, химическая кинетика химическое равновесие,
- 4. 1 семестр - зачет 2 семестр - экзамен Российская и международная система оценок Работа в семестре
- 5. Коровин Н.В. Общая химия. М.: Высшая школа. 2002, 2013 Ахметов, Н.С. Общая и неорганическая химия/Н.С. Ахметов.
- 6. Электронные курсы по Химии отдел дистанционного образования Управления ДПО Ананьева Е.А., Глаголева М.А., Звончевская М.Ф., Кучук
- 7. теоретическая часть; иллюстрации, видео, анимация; гиперссылки, аннотированные ссылки; контрольные и учебные тесты; глоссарий, персоналии. Что в
- 8. Где их найти?
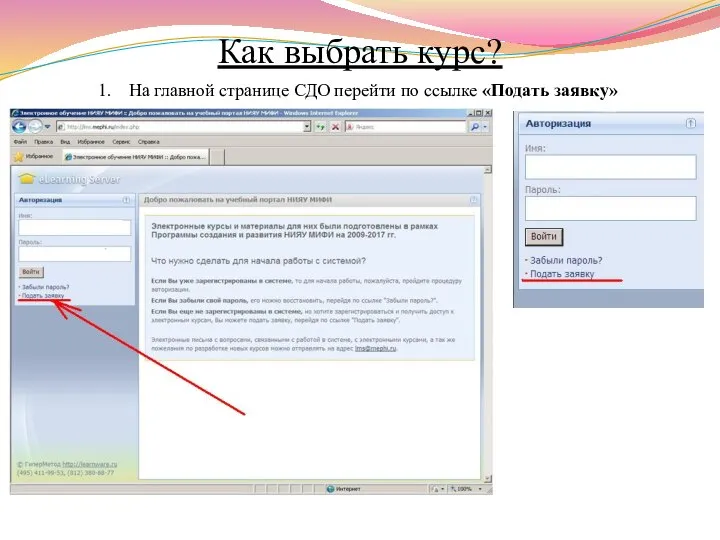
- 9. Как выбрать курс? На главной странице СДО перейти по ссылке «Подать заявку»
- 10. Электронные курсы по Химии отдел дистанционного образования Управления ДПО Ананьева Е.А., Глаголева М.А., Звончевская М.Ф., Кучук
- 11. теоретическая часть; иллюстрации, видео, анимация; гиперссылки, аннотированные ссылки; контрольные и учебные тесты; глоссарий, персоналии. Что в
- 12. Где их найти?
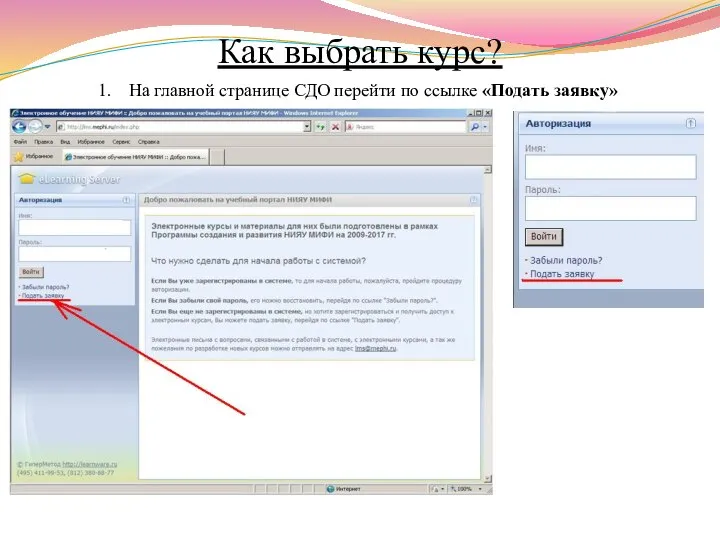
- 13. Как выбрать курс? На главной странице СДО перейти по ссылке «Подать заявку»
- 14. ЛЕКЦИЯ 1 ХИМИЧЕСКИЕ СИСТЕМЫ Введение Химия, как наука Химические системы Характеристика химических систем: Вещество, структурная единица
- 15. Классификация фундаментальных наук на уровне макрообъектов
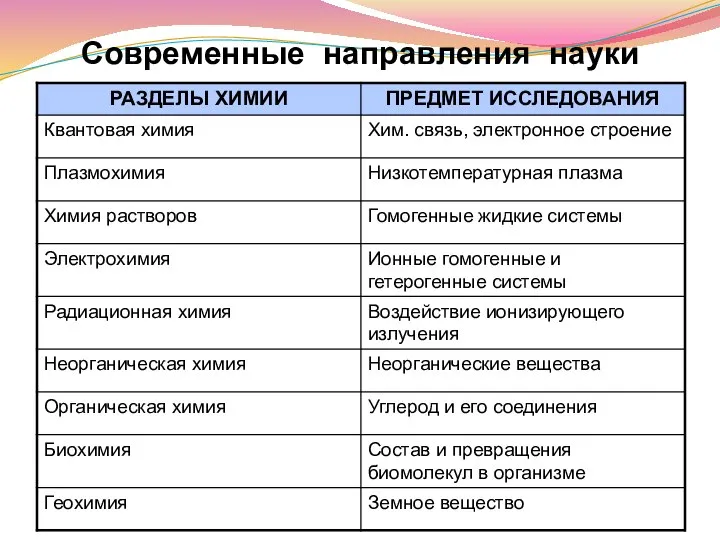
- 16. Современные направления науки
- 17. Химические системы - совокупность микро- и макроколичеств веществ, способных под воздействием внешних факторов к превращениям с
- 18. Факторы, условия Условия, при которых протекают реакции, принято указывать над стрелкой символизирующей химические превращения (р,Т, hν,
- 19. Факторы, условия кислотность среды
- 20. Характеристика кислотности среды Кислотность раствора определяется концентрацией ионов водорода. в нейтральной [H+] = [OH-] в кислой
- 21. Структурные единицы вещества: Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства, электронейтральная система,
- 22. Простые вещества – вещества , молекулы которых состоят из атомов одного и того же элемента. газ
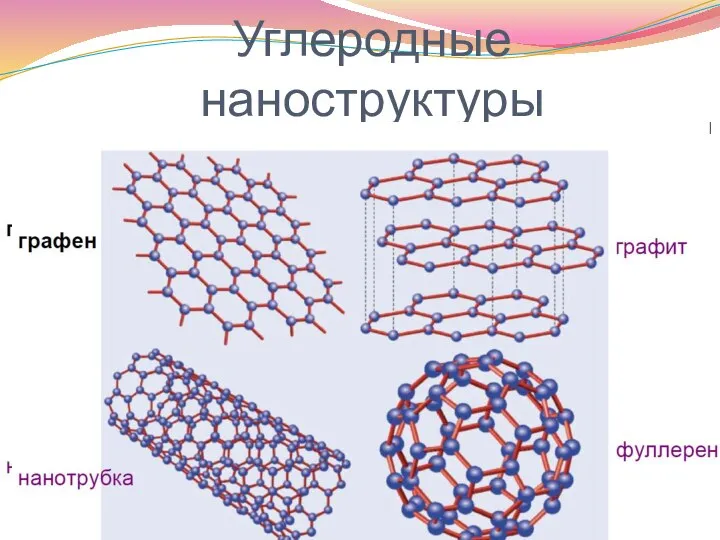
- 23. Углеродные наноструктуры
- 24. УГЛЕРОДНАЯ ЭЛЕКТРОНИКА ГРАФЕН
- 25. Основные признаки химических превращений выделение газа: образование осадка: выделение или поглощение тепла: изменение цвета, как результат
- 26. Метод классической химии Нобелевский лауреат Р. Фейнман: «Чтобы узнать, как расположены атомы в какой-нибудь невероятно сложной
- 27. Типы химических реакций Классификационные признаки: 1. Число и состав исходных веществ и продуктов реакции. 2. Тип
- 28. Типы химических реакций Реакция разложения: CaCO3 → CaO↓ + CO2↑ Реакция соединения: CO2↑ + H2O →
- 29. Ионно-молекулярные уравнения химических реакций Для того чтобы ионно-молекулярные уравнения правильно отражали механизм процесса, необходимо придерживаться следующей
- 30. Сильные электролиты Сильные кислоты: НNO3, HCl, HBr, HI, HClO4, H2SO4 и т.д. HnSOm где m-n ≥
- 31. Вещества, остающиеся ввиде молекул, при составлении ионных уравнений оксиды (пероксиды): BaO, P2O5, Al2O3, H2O, H2O2 и
- 32. Примеры ионных уравнений выделение газа выпадение осадка образоване малодис-социирующего вещества
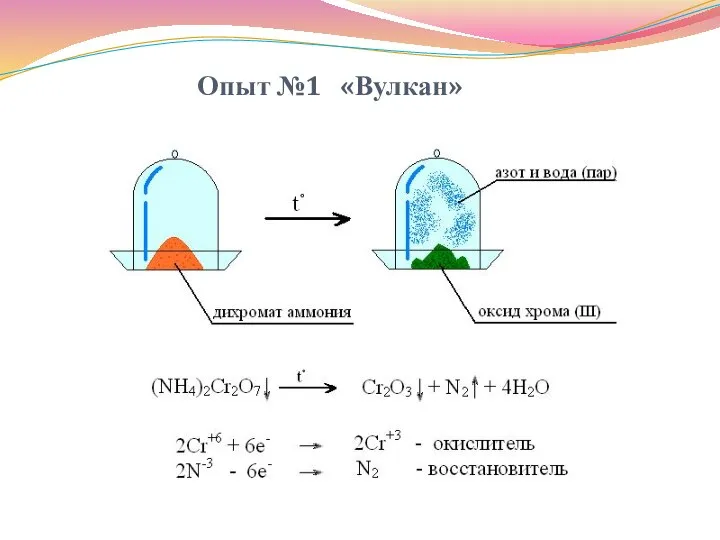
- 33. Опыт №1 «Вулкан»
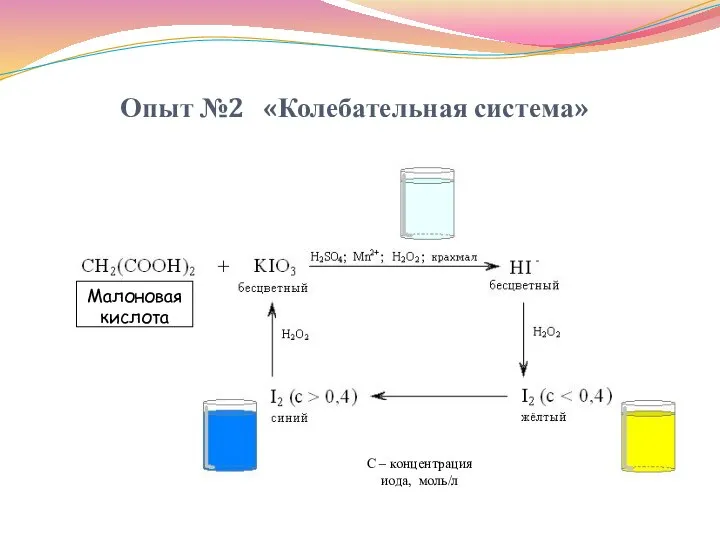
- 34. Опыт №2 «Колебательная система» Малоновая кислота С – концентрация иода, моль/л
- 35. Химическая двойственность Амфотерность гидроксида алюминия Al(OH)3 : Al(OH)3 + 3HCl → AlCl3 + 3HCl (pH основание
- 37. Скачать презентацию















![Характеристика кислотности среды Кислотность раствора определяется концентрацией ионов водорода. в нейтральной [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1086340/slide-19.jpg)












 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Презентация на тему Уголь
Презентация на тему Уголь  Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изомерия
Изомерия Разбор задач
Разбор задач Составление ионных уравнений
Составление ионных уравнений Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Основы кристаллографии
Основы кристаллографии Решение задач на смеси, растворы и сплавы
Решение задач на смеси, растворы и сплавы Альдегиды и кетоны
Альдегиды и кетоны План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Строение и свойства металлов
Строение и свойства металлов Презентация на тему Химические свойства бензола. Получение, применение
Презентация на тему Химические свойства бензола. Получение, применение  Кремний и его соединения
Кремний и его соединения Вода. Растворы
Вода. Растворы Органическая химия
Органическая химия Презентация на тему Оксиды
Презентация на тему Оксиды  Периодическая система и периодический закон. Тест
Периодическая система и периодический закон. Тест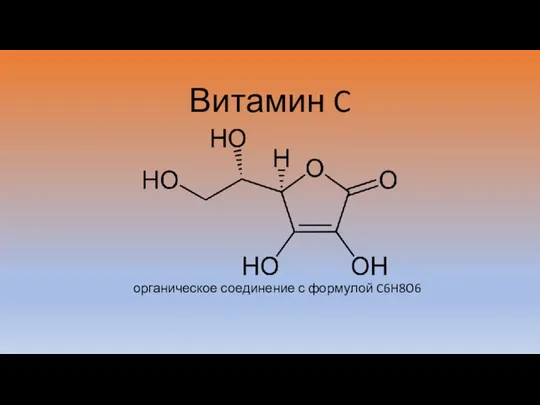 Витамин C
Витамин C Алюминий
Алюминий Очистка поваренной соли
Очистка поваренной соли Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини каталитический крекинг
каталитический крекинг Алканы
Алканы Алюміній. Фізичні та хімічні властивості
Алюміній. Фізичні та хімічні властивості Кислоты. Общая формула кислот
Кислоты. Общая формула кислот