Содержание
- 2. Щелочные металлы Преподаватель: Червонная Татьяна Артемовна, КубГУ ViTa_Chem&Bio
- 3. Способы получения щелочных металлов Все щелочные металлы встречаются в природе исключительно в виде соединений, являются сильными
- 4. Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция: 2NaCl 2Na + Cl2 Натрий можно
- 5. Взаимодействие с неметаллами Химические свойства оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует
- 6. Взаимодействие с водой Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды,
- 7. Щелочно-земельные металлы Преподаватель: Червонная Татьяна Артемовна, КубГУ ViTa_Chem&Bio
- 8. получают электролизом : Способы получения щелочно-земельных металлов и бериллия BeCl2 Be + Cl2 MgCl2 Mg +
- 9. Химические свойства
- 10. Химические свойства 2.4 Удивительные свойства 4
- 11. Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния: 2Mg + CO2
- 12. Качественные реакции щелочных и ЩЗ металлов по окраске пламени
- 14. Скачать презентацию











 Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты 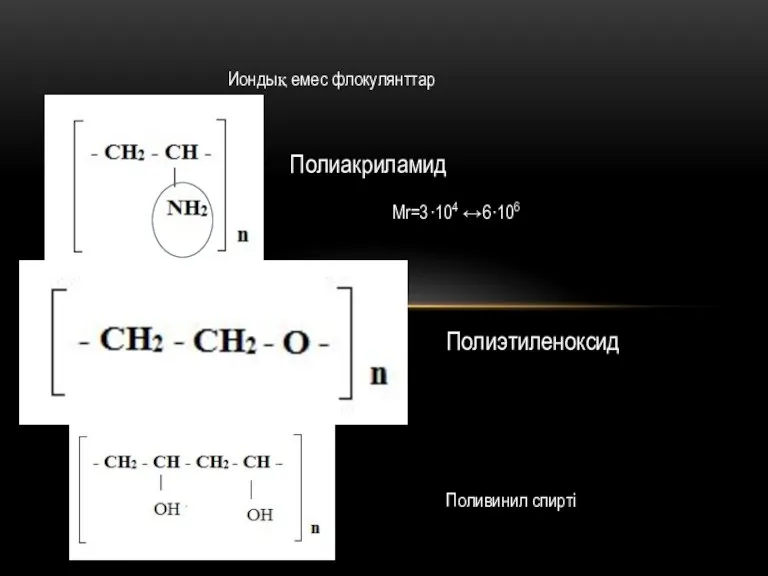 Иондық емес флокулянттар
Иондық емес флокулянттар Интегративный подход к обучению на уроках химии
Интегративный подход к обучению на уроках химии АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Свойства металлов, способы получения, их нахождение в природе, основные областях применения
Свойства металлов, способы получения, их нахождение в природе, основные областях применения Серная кислота
Серная кислота Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава 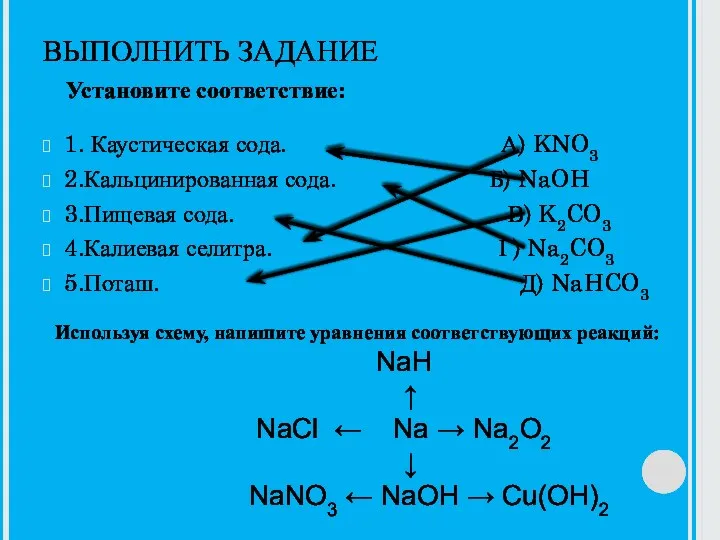 Каустическая сода
Каустическая сода Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Физика твердого тела. Введение в кристаллографию. Построение стереографических проекций
Физика твердого тела. Введение в кристаллографию. Построение стереографических проекций Виртуальная химическая лаборатория
Виртуальная химическая лаборатория Классификация спиртов
Классификация спиртов Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Алканы и алкены
Алканы и алкены Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН
Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН Кислоты. Классификация кислот
Кислоты. Классификация кислот Сложные эфиры. Организация внеаудиторной творческой работы учащихся
Сложные эфиры. Организация внеаудиторной творческой работы учащихся лекция 1-к.н.с.-ИАИТ-2022
лекция 1-к.н.с.-ИАИТ-2022 Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Свойства бензола
Свойства бензола Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Стехиометрические законы химии
Стехиометрические законы химии