Содержание
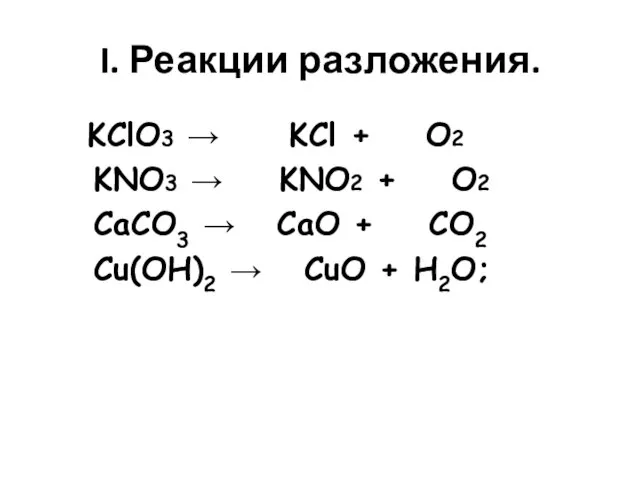
- 2. I. Реакции разложения. KClO3 → KCl + O2 KNO3 → KNO2 + O2 CaCO3 → CaO
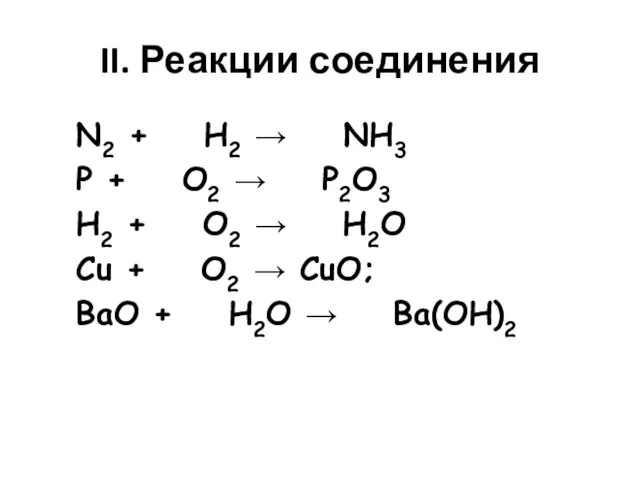
- 3. II. Реакции соединения N2 + H2 → NH3 P + O2 → P2O3 H2 + O2
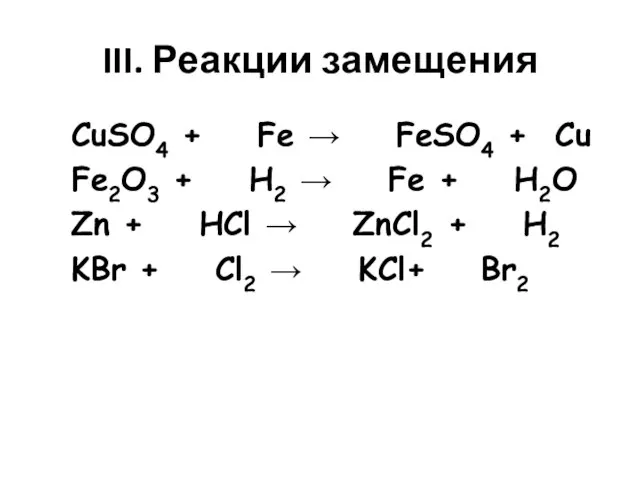
- 4. III. Реакции замещения CuSO4 + Fe → FeSO4 + Cu Fe2O3 + H2 → Fe +
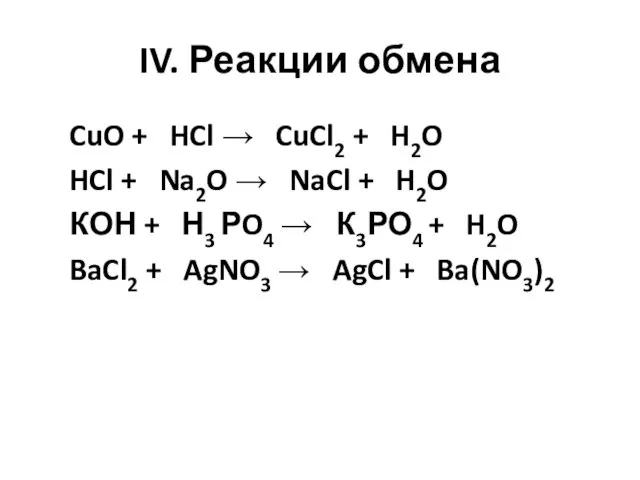
- 5. IV. Реакции обмена CuO + HCl → CuCl2 + H2O HCl + Na2O → NaCl +
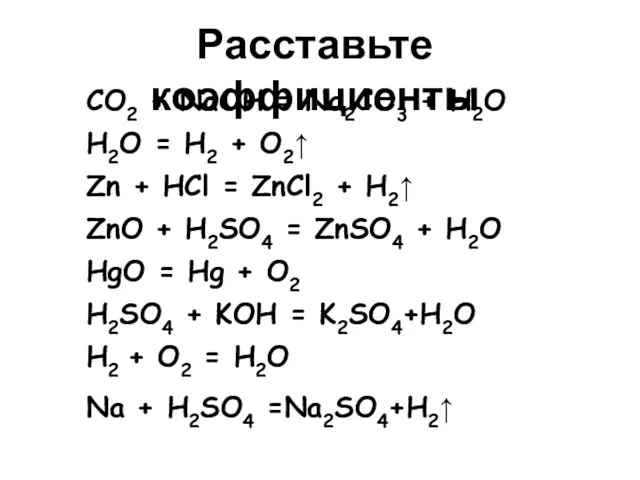
- 6. CO2 + NaOH = Na2CO3 + H2O H2O = H2 + O2↑ Zn + HCl =
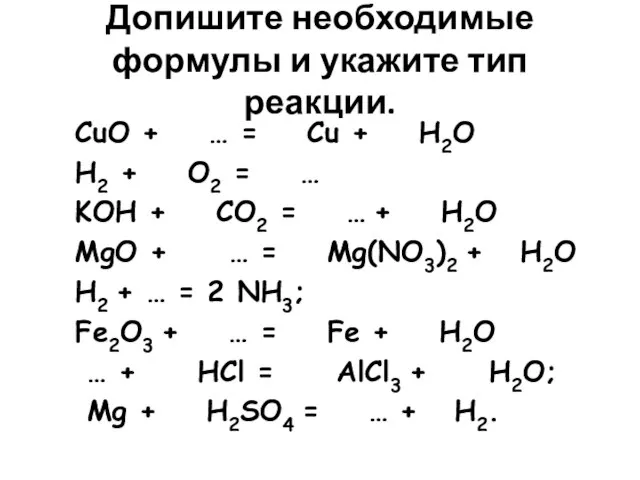
- 7. Допишите необходимые формулы и укажите тип реакции. CuO + … = Cu + H2O H2 +
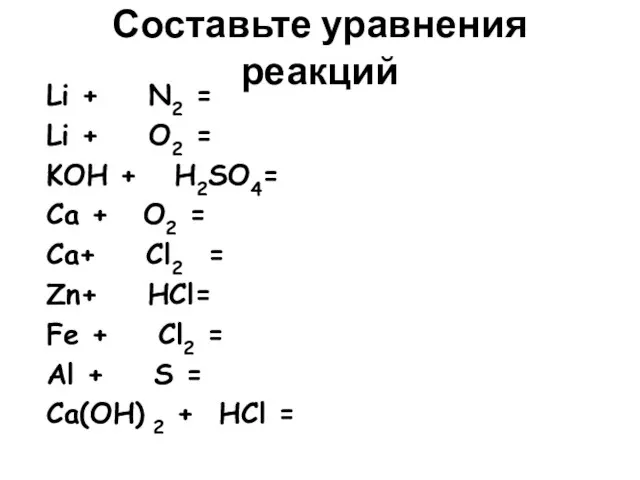
- 8. Составьте уравнения реакций Li + N2 = Li + O2 = KOH + H2SO4= Ca +
- 10. Скачать презентацию
 Презентация на тему Кальций
Презентация на тему Кальций  Опыт Пилатра де Розьера
Опыт Пилатра де Розьера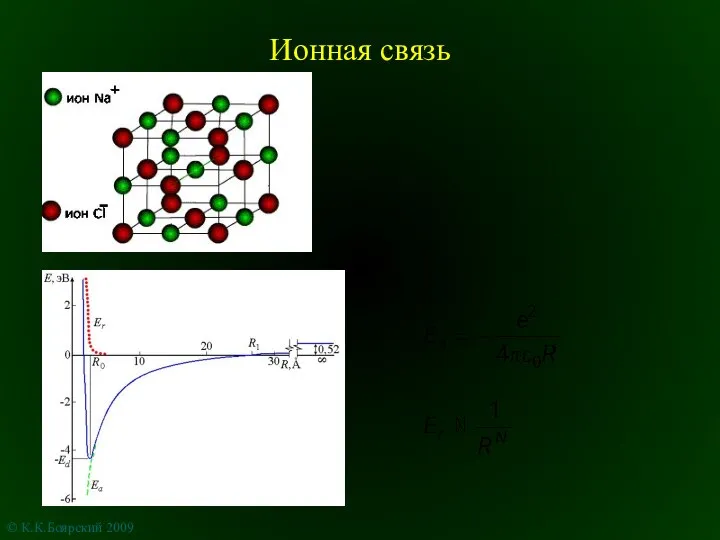 Ионная связь
Ионная связь Нуклеиновые кислоты
Нуклеиновые кислоты Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Первоначальные химические понятия
Первоначальные химические понятия Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Аминокислоты. Общая формула
Аминокислоты. Общая формула ЕГЭ по химии
ЕГЭ по химии Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Оксиды
Оксиды Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]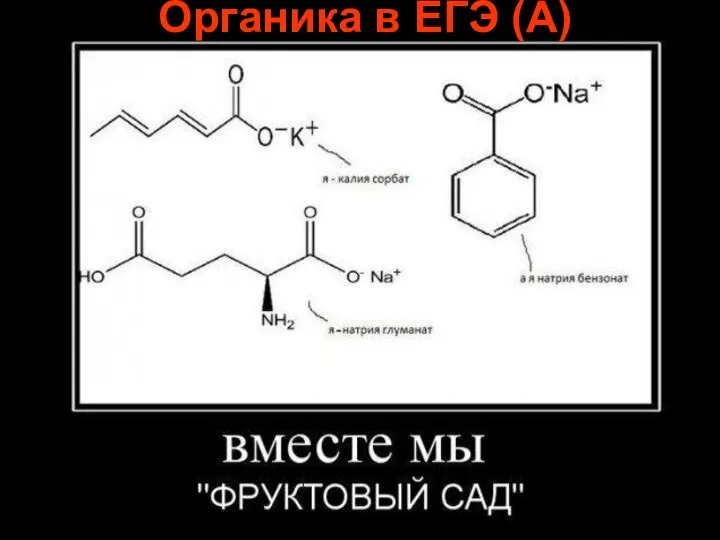 Органика в ЕГЭ (А)
Органика в ЕГЭ (А) Примеры реакций в жизни и в быту
Примеры реакций в жизни и в быту Problem-solving. Test: real-time polymerase chain reaction
Problem-solving. Test: real-time polymerase chain reaction Элементы таблицы Менделеева
Элементы таблицы Менделеева Квантовая химия
Квантовая химия Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Классификация неорганических веществ
Классификация неорганических веществ Классификация веществ. Урок №7
Классификация веществ. Урок №7 Азот, соединения азота
Азот, соединения азота Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической
Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической АТФ - аденозинтрифосфорная кислота
АТФ - аденозинтрифосфорная кислота Обобщающий урок по теме: Изменения происходящие с веществами
Обобщающий урок по теме: Изменения происходящие с веществами Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Основания
Основания Соли
Соли