Слайд 2Строение атома
Атом- мельчайшая химически неделимая электронейтральная частица вещества.
В центре атома находится положительно

заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны.
Виды элементарных частиц: протоны (р), нейтроны (n), электроны (е).
Общее число протонов и нейтронов в ядре атома называют массовым числом (Аr). А= n + p
Химический элемент- вид атомов с определенным зарядом ядра.
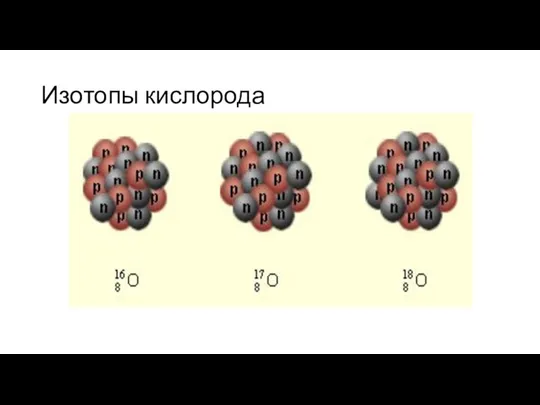
Изотопы- разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядре, но разную массу.
Слайд 4Строение атома
Изотопы отличаются друг от друга числом нейтронов в ядре.
Порядковый номер

химического элемента показывает: число протонов в ядре ( заряд ядра) и общее число электронов в атоме.
Номер периода показывает число энергетических уровней в атоме.
Номер группы- число электронов на последнем энергетическом уровне ( для элементов главных подгрупп).
Слайд 6Периодический закон
Д.И. Менделеева
Свойства химических элементов и образуемых ими простых и сложных

веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов
Слайд 8ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ

Слайд 9Энергия ионизации – энергия, необходимая для отрыва слабо связанного электрона от атома.
Металличность

– способность легко отдавать электроны.
Неметалличность – способность легко принимать электроны.
Электроотрицательность – способность атомов элементов в соединениях оттягивать на себя
электронную плотность. Самый электроотрицательный элемент – фтор.
Электроотрицательность при движении в периодах слева направо увеличивается,
в группах сверху вниз – уменьшается.
Периодичность изменения свойств элементов сказывается и на свойствах простых веществ, образованных
ими и на свойствах более сложных соединений: оксидов и гидроксидов.
Слайд 10ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ









 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алюминий
Алюминий Основания. Равновесия в растворах
Основания. Равновесия в растворах Электронный парамагнитный резонанс. Лекция 5
Электронный парамагнитный резонанс. Лекция 5 Алюминий
Алюминий Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Аминокислоты
Аминокислоты Спирты. Тест
Спирты. Тест Презентация на тему Вычисления массовой доли растворенного вещества
Презентация на тему Вычисления массовой доли растворенного вещества  Фенол. Понятие о фенолах
Фенол. Понятие о фенолах Сухой лёд
Сухой лёд Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Презентация на тему Теория электролитической диссоциации.
Презентация на тему Теория электролитической диссоциации.  Интрузивные контакты. Контакты интрузивных и осадочных пород
Интрузивные контакты. Контакты интрузивных и осадочных пород Химия в быту
Химия в быту Электроотрицательность
Электроотрицательность Углерод. Электронная формула
Углерод. Электронная формула Интеллектуальная игра по химии 4х4
Интеллектуальная игра по химии 4х4 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Полупроводники. Германий и кремний
Полупроводники. Германий и кремний Применение эфиров в производстве автомобильных бензинов
Применение эфиров в производстве автомобильных бензинов Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер
Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер Гидролиз солей
Гидролиз солей Классификация веществ
Классификация веществ Насыщенные жирные кислоты
Насыщенные жирные кислоты Неорганические и органические кислоты
Неорганические и органические кислоты Относительная молекулярная масса
Относительная молекулярная масса