Содержание
- 2. Изомерия (от греческих слов «изос» – «равный» и «мерос» – «часть», «доля») — явление существования химических
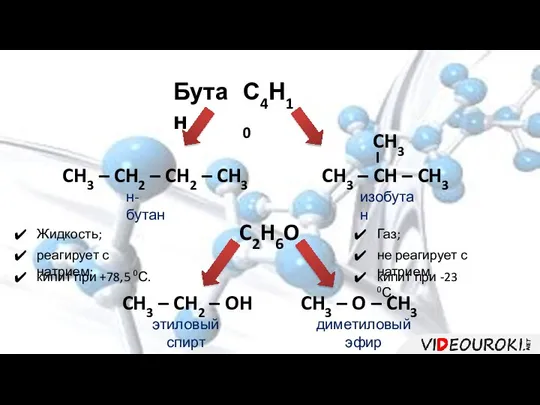
- 3. Бутан С4Н10 CH3 – CH2 – CH2 – CH3 н-бутан изобутан C2H6O CH3 – CH2 –
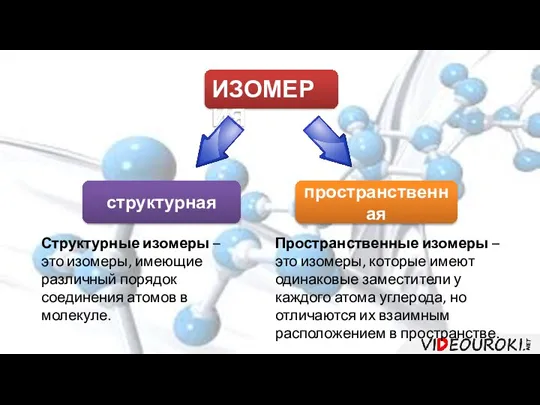
- 4. ИЗОМЕРИЯ структурная пространственная Структурные изомеры – это изомеры, имеющие различный порядок соединения атомов в молекуле. Пространственные
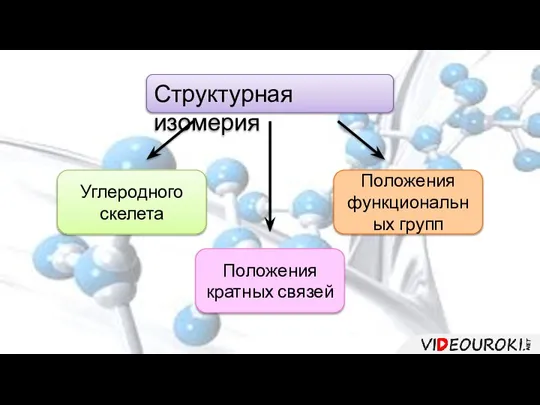
- 5. Структурная изомерия Углеродного скелета Положения функциональных групп Положения кратных связей
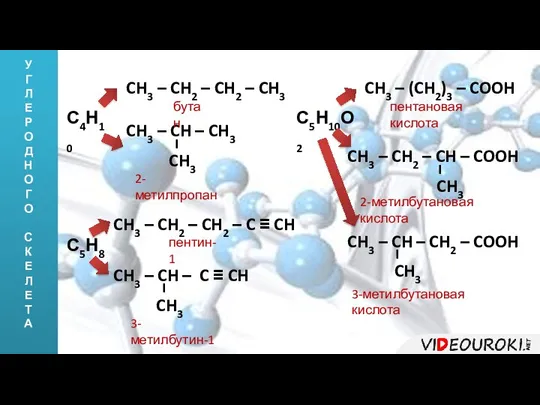
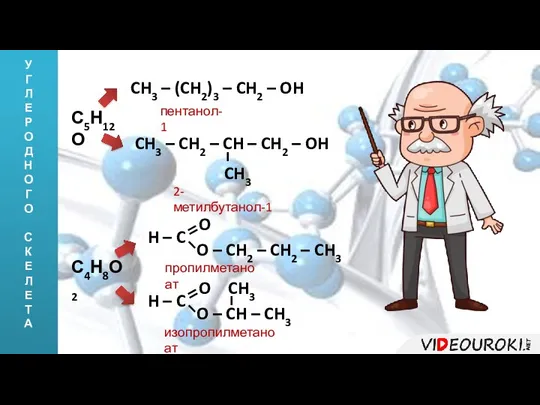
- 6. У Г Л Е Р О Д Н О Г О С К Е Л Е
- 7. У Г Л Е Р О Д Н О Г О С К Е Л Е
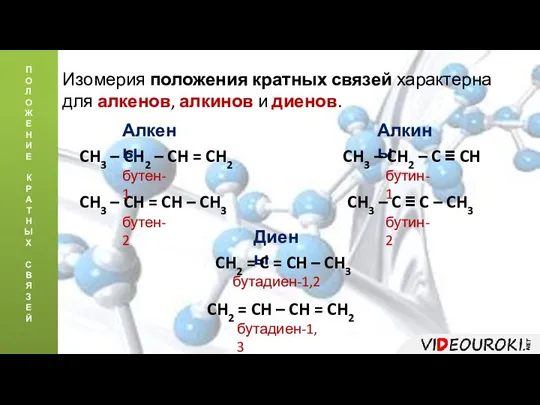
- 8. П О Л О Ж Е Н И Е К Р А Т Н Ы Х
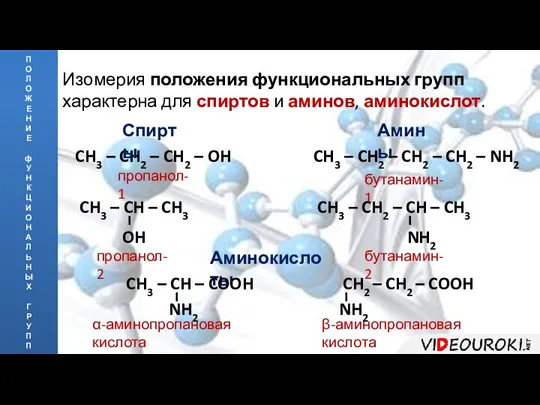
- 9. П О Л О Ж Е Н И Е ф У Н К Ц И О
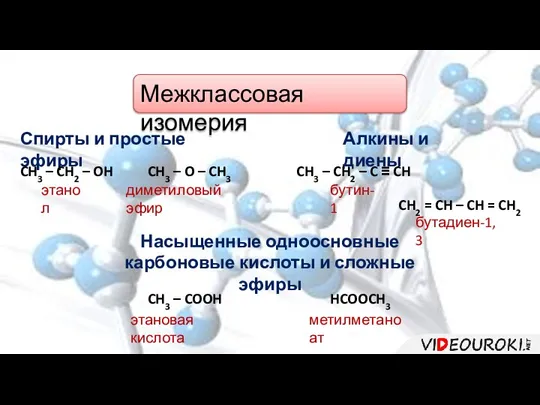
- 10. Межклассовая изомерия Спирты и простые эфиры Алкины и диены Насыщенные одноосновные карбоновые кислоты и сложные эфиры
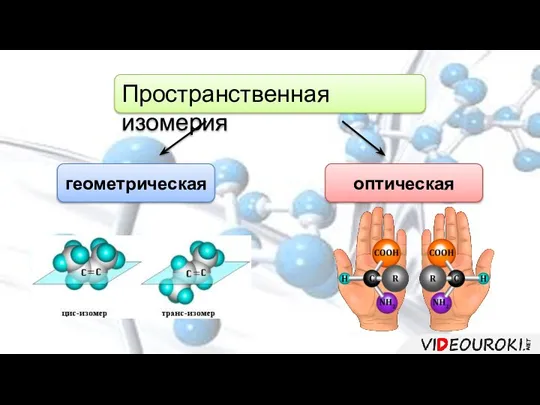
- 11. Пространственная изомерия геометрическая оптическая
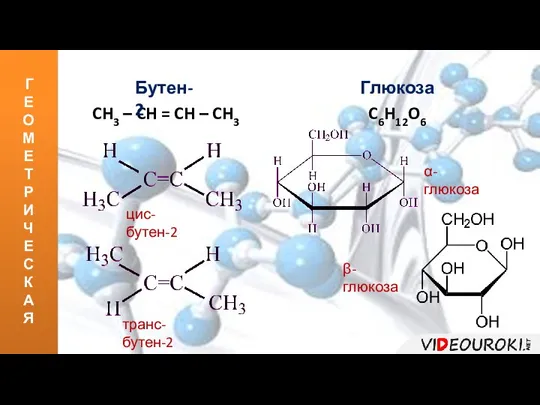
- 12. Г Е О М Е Т Р И Ч Е С К А Я CH3 –
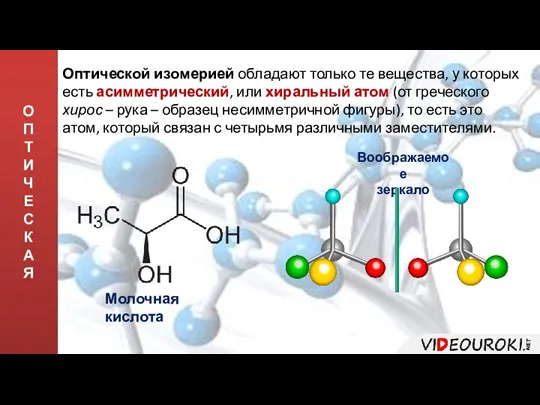
- 13. О П Т И Ч Е С К А Я Оптической изомерией обладают только те вещества,
- 15. Скачать презентацию

 Типичные экспериментальные кинетические данные
Типичные экспериментальные кинетические данные Получение серной кислоты
Получение серной кислоты Спирты в жизни человека
Спирты в жизни человека Общая характеристика галогенов
Общая характеристика галогенов Group 6 Cations
Group 6 Cations Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции  Алюминий
Алюминий Мило. Його склад. Мийна дія
Мило. Його склад. Мийна дія Карбоновые кислоты
Карбоновые кислоты Химическая связь
Химическая связь Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева
Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева Получение аммиака и изучение его свойств. Практическая работа № 2
Получение аммиака и изучение его свойств. Практическая работа № 2 Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича
Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики
Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики Электролитическая диссоциация
Электролитическая диссоциация Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Тематическая викторина Химические элементы, металлы и неметаллы
Тематическая викторина Химические элементы, металлы и неметаллы Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Мыло. Интересно об известном
Мыло. Интересно об известном Классификация неорганических веществ
Классификация неорганических веществ Bool-doser team
Bool-doser team