Содержание
- 2. Цель проекта: Знакомство с водородом как элементом и веществом Рассматриваемые вопросы: История открытия элемента Строение атома
- 3. Рабочие группы: 1 группа – «Теоретики» 2 группа – «Исследователи» 3 группа – «Практики»
- 4. История открытия Впервые этот газ в чистом виде выделил 240 лет назад английский химик Генри Кавендиш.
- 5. Другой великий химик, француз Антуан-Лоран Лавуазье, уже в 1787 году доказал, что полученное Кавендишем вещество —
- 6. Водород в природе: Водород широко распространен в природе — содержится в воде, во всех органических соединениях,
- 7. Водород самый распространенный элемент во вселенной
- 8. Общая характеристика: Порядковый номер 1 1 малый период I группа главная подгруппа Ar=1 Электронная конфигурация 1S1
- 9. Молекула водорода Молекула водорода состоит из двух атомов - H2 Ковалентная неполярная связь Н:Н
- 10. Получение водорода в лаборатории Zn + 2HCl → ZnCl2 + H2↑ 2H2 + O2 = 2H2O
- 11. Физические свойства водорода Бесцветный газ Без запаха Почти нерастворим в воде В 14,5 раз легче воздуха
- 12. Промышленные способы получения водорода Водород получают конверсией водяных паров с углем или метаном H2O + C
- 13. Восстановительные свойства водорода Горит в кислороде 2H2 + O2 = 2H2O Реагирует с другими неметаллами N2
- 14. Взаимодействие водорода с оксидом меди (II)
- 15. Окислительные свойства водорода Реагируют со щелочными и щелочноземельными металлами с образованием гидридов 2Na + H2 =
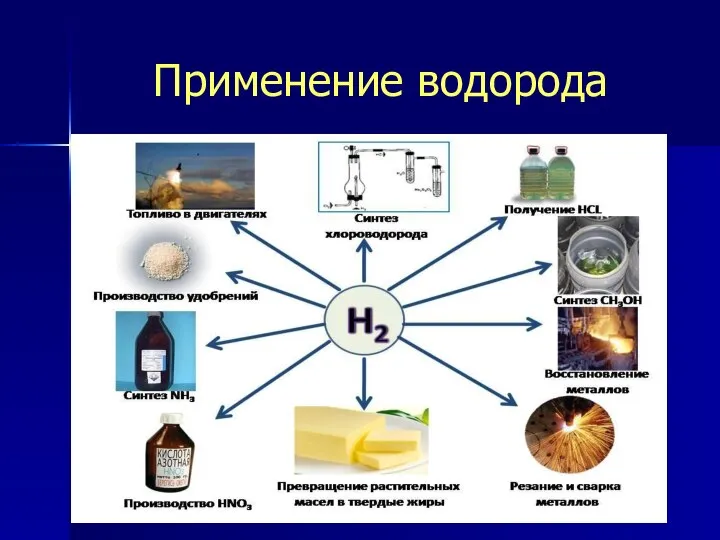
- 16. Применение водорода
- 17. Применение водорода Применение Свойства водорода Горит с выделением большого количества теплоты Реагирует с неметаллами Реагирует с
- 18. Применение Наработав в достаточном количестве этот легкий газ, люди сначала приспособили его для воздушных полетов. В
- 19. Водородная энергетика: миф или реальность? В недалёком будущем основным источником получения энергии станет реакция горения водорода,
- 20. Контрольные вопросы: Какой элемент характеризуется наибольшей распространенностью во Вселенной? Кто впервые выделил водород в чистом виде?
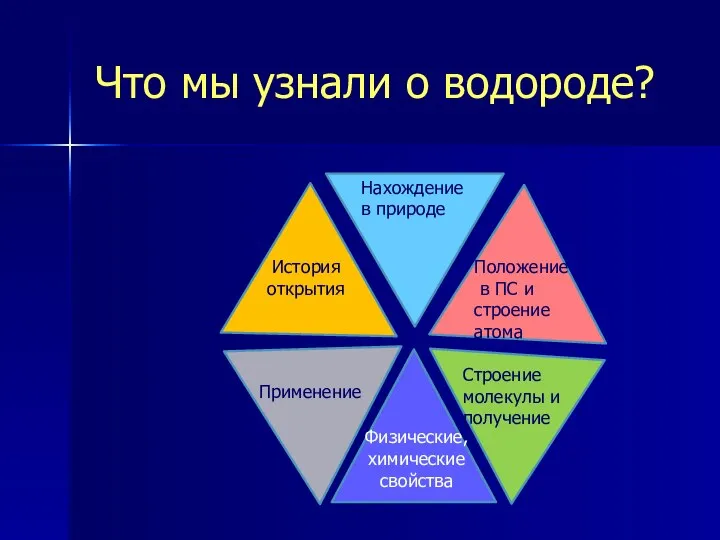
- 21. Что мы узнали о водороде? Положение в ПС и строение атома История открытия Нахождение в природе
- 23. Скачать презентацию


















 Алмашу реакциясе
Алмашу реакциясе Химические реактивы
Химические реактивы Химическое сопротивление материалов
Химическое сопротивление материалов Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Основы стереохимии
Основы стереохимии Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Алифатические и ароматические амины
Алифатические и ароматические амины Антитела. Что такое антитела?
Антитела. Что такое антитела? Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Степень окисления
Степень окисления Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Производство метанола
Производство метанола Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement) Самородные элементы. Сера. Лекция 7
Самородные элементы. Сера. Лекция 7 صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Природные источники углеводородов
Природные источники углеводородов Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Минералы. Определения, понятия
Минералы. Определения, понятия Закон эквивалентов
Закон эквивалентов Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация