Содержание
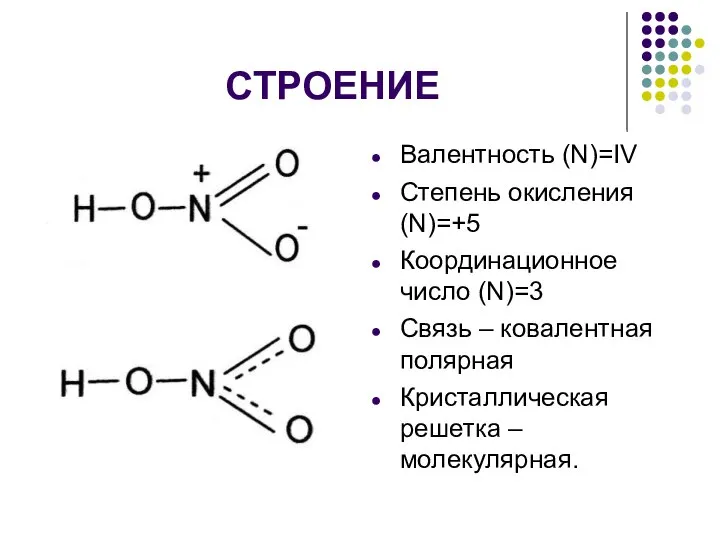
- 2. СТРОЕНИЕ Валентность (N)=IV Степень окисления (N)=+5 Координационное число (N)=3 Связь – ковалентная полярная Кристаллическая решетка –
- 3. ХАРАКТЕРИСТИКА HNO3 Одноосновная Кислородсодержащая Нестабильная Летучая Сильный электролит Сильный окислитель 4HNO3→ 4NO2 + 2H2O + O2
- 4. Физические свойства Безводная HNO3 при обычной температуре – бесцветная летучая жидкость со специфическим запахом, tкип.=82,6°С, концентрированная
- 5. А. Общие с другими кислотами: 1) Действие на индикаторы HNO3 ⮀ H++NO3- Синий лакмус ⭢ красный
- 6. 2) Взаимодействие с основными и амфотерными оксидами CuO+2HNO3⭢Cu(NO3)2+H2O CuO+2H+⭢Cu2++H2O 3) Взаимодействие с основаниями KOH+HNO3⭢KNO3+H2O OH-+H+⭢H2O 4)
- 7. Б. Окислительные свойства. 1) Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий
- 8. Cu+4HNO3(конц.) ⭢Cu(NO3)2+2NO2+2H2O 3Cu+8HNO3(разб.) ⭢3Cu(NO3)2+2NO+4H2O
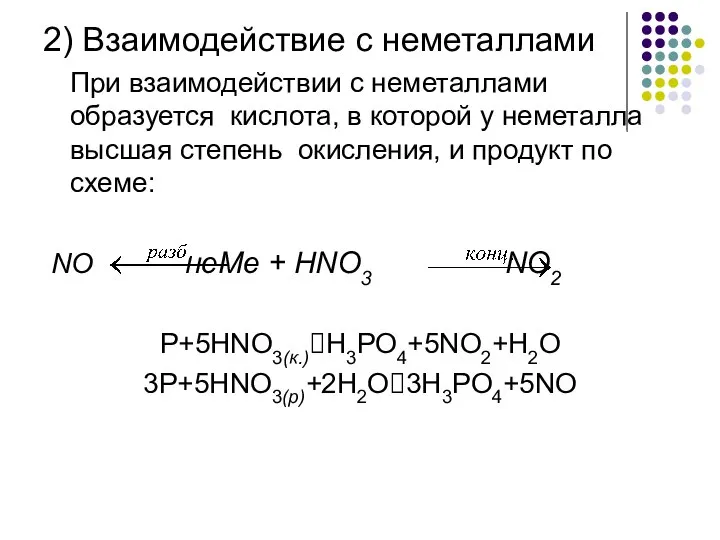
- 9. 2) Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень
- 11. Скачать презентацию






 Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Презентация на тему Великие ученые-химики
Презентация на тему Великие ученые-химики  Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Соединения железа в природе
Соединения железа в природе Относительная атомная масса элементов
Относительная атомная масса элементов Соли
Соли Понятие о спиртах
Понятие о спиртах Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Опыты с водой
Опыты с водой Твердые материалы для художественно-оформительских работ
Твердые материалы для художественно-оформительских работ Свойства растворов электролитов
Свойства растворов электролитов teoria_Butlerova
teoria_Butlerova Металлы. Группы металлов
Металлы. Группы металлов Презентация на тему Менделеев Дмитрий Иванович
Презентация на тему Менделеев Дмитрий Иванович  Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Высокоэффективная жидкостная препаративная хроиматография
Высокоэффективная жидкостная препаративная хроиматография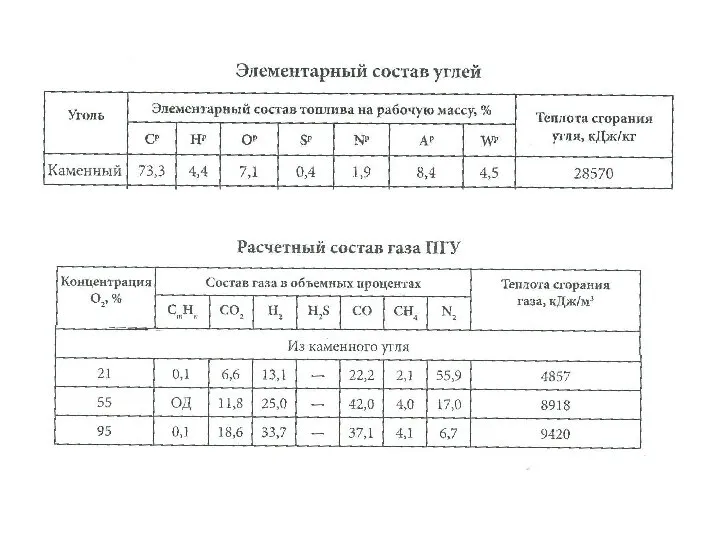 Элементарный состав углей
Элементарный состав углей Соединения галогенов
Соединения галогенов Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ
Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений
Основные положения теории строения органических соединений А. М. Бутлерова. Многообразие органических соединений Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Металлы
Металлы Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Вирощування кристалів солей
Вирощування кристалів солей Материаловедение. Полимерные материалы
Материаловедение. Полимерные материалы