Слайд 3 Цели урока:
1) рассмотреть строение и свойства многоатомных спиртов, максимально используя имеющиеся

знания о составе, строении и свойствах одноатомных спиртов;
2) показать взаимосвязь многоатомных и одноатомных спиртов;
3) сформировать понятие об особых свойствах многоатомных спиртов через организацию исследовательской деятельности на уроке;
4) показать применение многоатомных спиртов.
Слайд 4Устный опрос :
Какие вещества называются спиртами?

Слайд 5Как классифицируют спирты по числу ОН-групп, и по Rad?

Слайд 7Работа на местах
Написать формулу:
2-метилбутанол
2-метил-пентанол-3
Осуществить превращение:
C2 H6 → C2 H4 →

C2 H5 O H → C2 H5 CI
↓
C2 H4
Слайд 8 Дать название следующим веществам:
CH2—CH—CH2—CH2 — CH2—CH2—OH
I
CH3
CH3
⏐
OH---
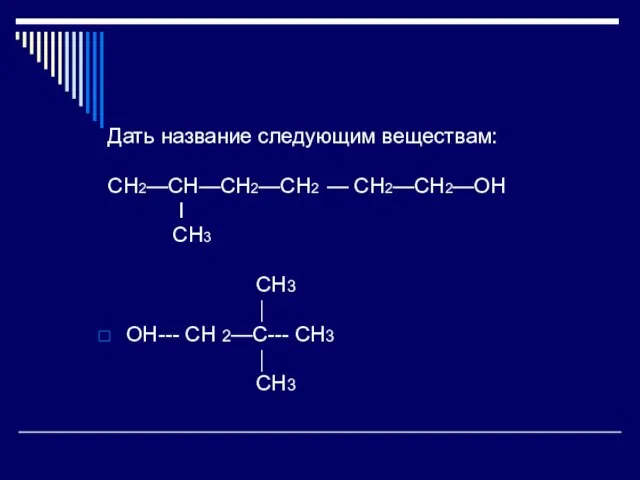
CH 2—C--- CH3
⏐
CH3
Слайд 9 МОТИВАЦИЯ к восприятию нового материала:
Что мы знаем о многоатомных спиртах? Используем

ли их в повседневной жизни?
Как вы думаете, что представляет собой глицерин?
Что вы знаете о незамерзающих жидкостях?
Химические свойства многоатомных спиртов
Применение спиртов.
Лабораторный опыт
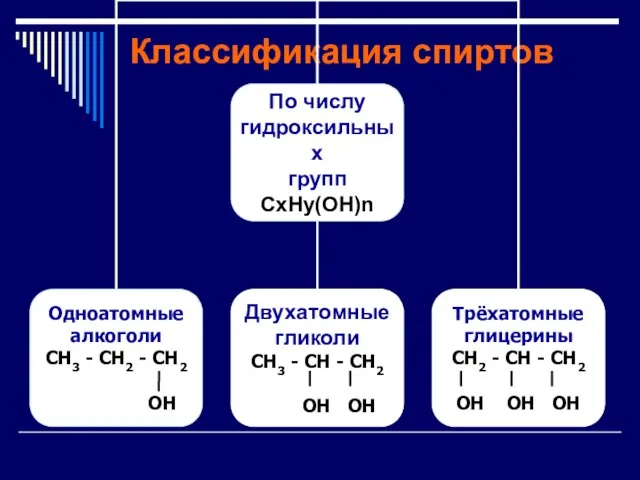
Слайд 10 Многоатомные спирты – это органические соединения, в молекулах которых содержатся две

или более гидроксильных групп, соединенных с углеводородным радикалом .
Слайд 12Названия спиртов
Для многоатомных спиртов перед суффиксом -ол по-гречески
(-ди-, -три-, ...)

указывается количество
гидроксильных групп.
Слайд 13Многоатомный спирт -этиленгликоль
Этиленгликоль — представитель предельных двухатомных спиртов — гликолей.
Название гликоли

получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Слайд 14Многоатомный спирт - глицерин
Глицерин – трехатомный предельный спирт.
Бесцветная, вязкая, гигроскопичная, сладкая

на вкус жидкость.
Смешивается с водой в любых отношениях , неограниченно растворим в воде.
Реагирует с азотной кислотой с образованием нитроглицерина.
С карбоновыми кислотами образует жиры и масла.
Глицерин в отличие от этиленгликоля- не ядовит.
Слайд 16
Качественной реакцией на многоатомные спирты
является их взаимодействие со свежеполученным осадком гидроксида меди(

II), который растворяется с образованием ярко- синего раствора
Слайд 17Применение этиленгликоля
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, от чего

вещество нашло широкое применения как компонент автомобильных антифризов и незамерзающих жидкостей.
Он применяется для получения лавсана (ценного синтетического волокна).
Слайд 18Этиленгликоль – яд !
Дозы вызывающие смертельное отравление этиленгликолем варьируются в широких

пределах - от 100 до 600 мл. Смертельной дозой для человека является 50-150 мл. Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.
Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Слайд 19Применение глицерина
В производстве взрывчатых веществ, в частности тринитрата глицерина.
При обработке кожи, для

предотвращения от высыхания.
В текстильной промышленности для придания тканям мягкости и шелковистости.
Как компонент некоторых клеeв.
При производстве пластмасс в качестве пластификатора – компонента, придающего материалу гибкость и эластичность.
В производстве кондитерских изделий и напитков (как пищевая добавка E422).
Широко используется в парфюмерной промышленности: входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.
Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
















 Анализ саморазряда элементов литий-дисульфид железа
Анализ саморазряда элементов литий-дисульфид железа Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Схема реакций
Схема реакций Закономерности управления каталитическими процессами. Катализ
Закономерности управления каталитическими процессами. Катализ Железо. 9 класс
Железо. 9 класс Водород. Свойства, применение
Водород. Свойства, применение Спирты, карбоновые кислоты
Спирты, карбоновые кислоты Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Алюминий. Применение
Алюминий. Применение Л1.3. Фазы в металлических сплавах
Л1.3. Фазы в металлических сплавах Три службы Менделеева для России
Три службы Менделеева для России Обобщающий урок по теме «Соединения химических элементов» 8 класс.
Обобщающий урок по теме «Соединения химических элементов» 8 класс. Метионин
Метионин Исследование молока
Исследование молока ЦОКО 2 курс. Химия
ЦОКО 2 курс. Химия Полимеры и пластмассы
Полимеры и пластмассы Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Жиры
Жиры Презентация по Химии "Алмаз"
Презентация по Химии "Алмаз"  Презентация лек №2
Презентация лек №2 Строение атома Степень окисления. Валентность. Ионы
Строение атома Степень окисления. Валентность. Ионы Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)