Содержание
- 2. Цель: научить вести расчеты по уравнению химической реакции, зная количество вещества, массу или объем одного из
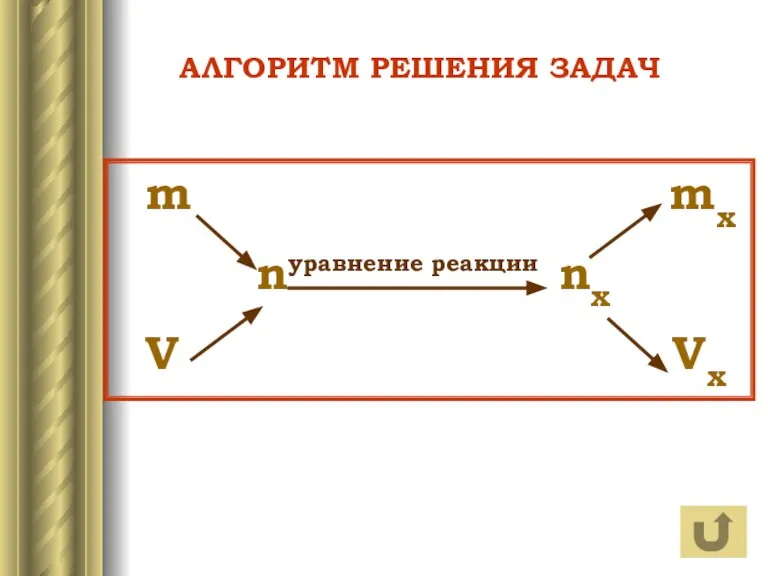
- 3. АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ
- 4. Дано: n(H2) = 1,5 моль n(Al) – ? Решение: x моль 1,5 моль 2Al + 6HCl
- 5. Дано: n(Al2S3) =2,5 моль n(S) – ? Решение: x моль 2,5 моль 2Al + 3S =
- 6. Дано: m(Cu(OH)2)=14,7 г m(CuO) – ? M(Cu(OH)2) = 64+(16+1)·2 = 98г/моль M(CuO) = 64 +16 =
- 7. Дано: m(Zn)=13 г m(ZnCl2) – ? M(Zn) = 65 г/моль M(ZnCl2 =65 +35,5·2 = 136 г/моль
- 8. Дано: m(MgO) = 6 г V(O2) – ? M(MgO) = 24+16 = 40 г/моль Vm =
- 9. Дано: m(Cu)=32 г V(H2) – ? M(Cu) = 64 г/моль Vm = 22,4 л/моль Решение: x
- 10. САМОСТОЯТЕЛЬНАЯ РАБОТА: ВАРИАНТ 1: Вычислите массу меди, которая образуется при восстановлении избытком водорода 4 г оксида
- 11. ДОМАШНЕЕ ЗАДАНИЕ: Рассчитайте, какая масса кислорода образуется при разложении 108 г воды. Вычислите объем (н.у.) газа,
- 13. Скачать презентацию









 Кремний и его соединения
Кремний и его соединения Жизнь и деятельность А.М. Бутлерова
Жизнь и деятельность А.М. Бутлерова Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Газообразные вещества и их применение
Газообразные вещества и их применение Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН
Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Химические свойства кислот
Химические свойства кислот Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Аттестационная работа. Музей минералов и горных пород
Аттестационная работа. Музей минералов и горных пород Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша
Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша Презентация на тему Строение Бензола
Презентация на тему Строение Бензола  Степень окисления
Степень окисления Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Вещество как система. Номенклатура неорганических веществ
Вещество как система. Номенклатура неорганических веществ Минералы. Внутренняя структура минералов
Минералы. Внутренняя структура минералов Определение времени прохождения диффузии
Определение времени прохождения диффузии Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Химический тренажер
Химический тренажер Реакции разложения
Реакции разложения Алкадиены. Физические свойства
Алкадиены. Физические свойства Спирты и фенолы. (Лекция 6.1)
Спирты и фенолы. (Лекция 6.1) Классы неорганических соединений (основания)
Классы неорганических соединений (основания) Строение и химические свойства галогенов
Строение и химические свойства галогенов Соединения азота в атмосфере. Лекция 4
Соединения азота в атмосфере. Лекция 4 Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Пидорасня
Пидорасня