Содержание
- 2. 2. Молекули електролітів у воді розпадаються на йони: КАТІОНИ (+) та АНІОНИ (–) 3. Сума зарядів
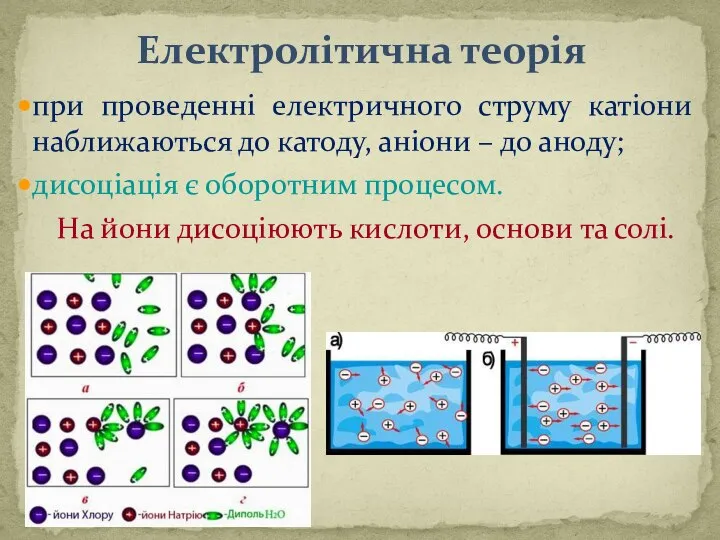
- 3. Властивості розчинів електролітів Речовини, розчини і розплави яких проводять електричний струм, називають електролітами. Властивості розчинів електролітів
- 4. ДИСОЦІАЦІЯ – це процес розпаду молекул електролітів на йони. CaCl2 → Ca2+ + 2Clˉ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ
- 5. Електролітична теорія Запропонована шведським вченим Сванте Ареніусом, який стверджував, що: за відсутності електричного струму в розчині
- 6. Електролітична теорія при проведеннi електричного струму катiони наближаються до катоду, анiони – до аноду; дисоціація є
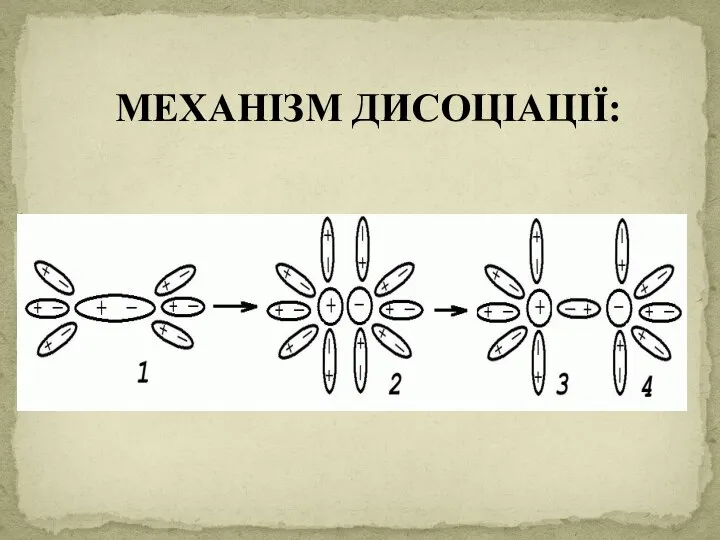
- 7. МЕХАНІЗМ ДИСОЦІАЦІЇ:
- 8. Дисоціація кислот Кислоти – електроліти, які при дисоціації у водних розчинах дають катіони водню (гидроксония Н3О+)
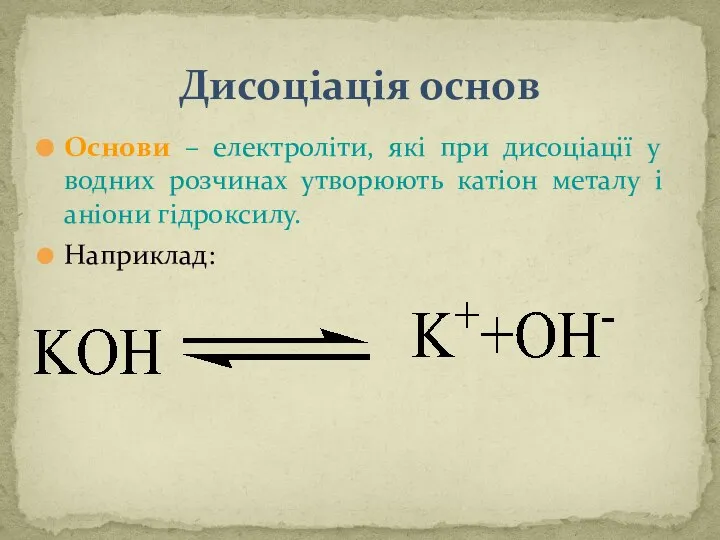
- 9. Дисоціація основ Основи – електроліти, які при дисоціації у водних розчинах утворюють катіон металу і аніони
- 10. Дисоціація солей Солі – електроліти, які при дисоціації у водних розчинах дають катіони металів, NH4+ та
- 11. ОСОБЛИВОСТІ РОЗЧИНІВ КИСЛОТ І ОСНОВ 1. ДИСОЦІАЦІЯ КИСЛОТ НCl ↔ Н+ +Сl– H2SO4 ↔ 2Н+ +
- 12. 2. ДИСОЦІАЦІЯ ОСНОВ. NaOH ↔ Na+ + ОН– Основи, які мають декілька груп ОН– дисоціюють ступінчасто:
- 13. Кількісною мірою дисоціації електролітів є КОНСТАНТА ДИСОЦІАЦІЇ (Кд) – дорівнює відношенню добутку молярних концентрацій йонів до
- 14. Кількісною характеристикою розпаду молекул на йони є СТУПІНЬ ДИСОЦІАЦІЇ (α), дорівнює відношенню числа молекул, що розпалися
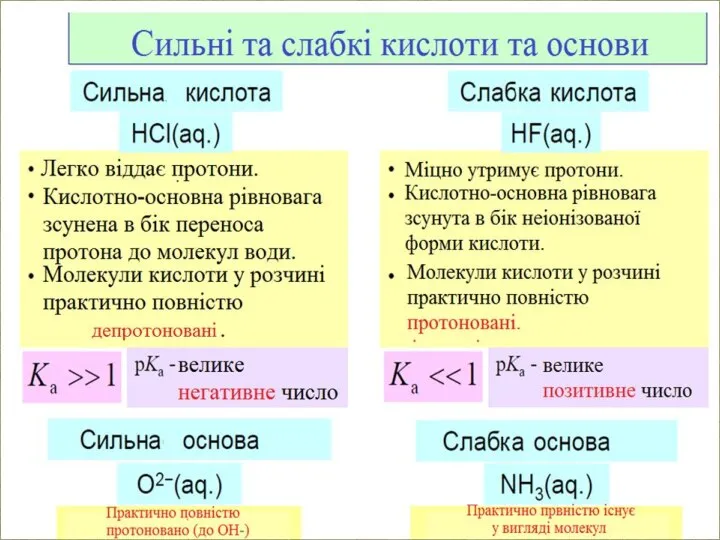
- 15. За ступенем дисоціації, всі електроліти діляться на СИЛЬНІ та СЛАБКІ: Сильні електроліти при розчиненні у воді
- 16. Властивості розчинів сильних електролітів У розчинах сильних електролітів концентрацію замінюють на активність (позначає ефективну, умовну концентрацію,
- 17. Коефіцієнт активності. Йонна сила розчину Коефіцієнт активності йонів є функцією не тільки концентрації йонів. Він також
- 18. Рівновага в розчинах слабких електролітів Для рівняння дисоціації слабкого електроліту КА: К2А 2К++А- Вираз для константи
- 19. ЗАКОН РОЗВЕДЕННЯ ОСТВАЛЬДА: Ступінь дисоціації слабих бінарних електролітів обернено пропорційний кореню квадратному із їх концентрації або
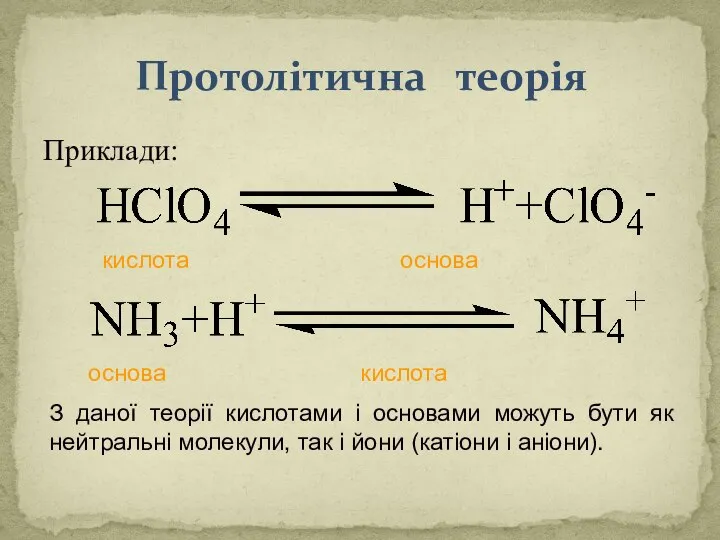
- 20. Протолітична теорія Датський фізико-хімік Йоханнес Бренстед і англійський хімік Томас Лоурі в 1928-1929 р. запропонували протолітичну
- 21. Протолітична теорія Основа – це речовина (частка), здатна приєднувати протон (тобто основа – акцептор протона). В
- 22. Протолітична теорія Приклади: Сіль - продукт взаємодії кислоти та основи. NaOH + НСl = NaCl +
- 23. Протолітична теорія Приклади: кислота основа основа кислота З даної теорії кислотами і основами можуть бути як
- 24. Електронна теорія Запропонована в 1926 р. американським вченим Гілбертом Льюїсом. Відповідно до даної теорії: Кислотами називають
- 25. Електронна теорія В результаті цієї взаємодії кислота і основа взаємодіють між собою з утворенням зв'язку за
- 26. Константи кислотності й основності Константи дисоціації кислот і основ називають відповідно константи кислотності (КА) та основності
- 27. Чим менша Kb (більше значення pKb), тим слабкіша основа
- 29. ДИСОЦІАЦІЯ ВОДИ Згідно з теорією Бренстеда вода відносно самої себе є одночасно і кислотою і основою
- 30. Йонний добуток води Експериментально встановлено, що вода проводить електричний струм, але деіонізована вода має дуже великий
- 31. КОНСТАНТИ РІВНОВАГИ Оскільки ступінь дисоціації води дуже низький (з 550 млн. молекул води - дисоціює тільки
- 32. ВОДНЕВИЙ ПОКАЗНИК (рН) – це негативний десятковий логарифм молярної концентрації гідроген-йонів рН = – lg [H+]
- 33. Водневий показник рН = -lg[H+] або [H+]=10-рН рН + рОН = 14
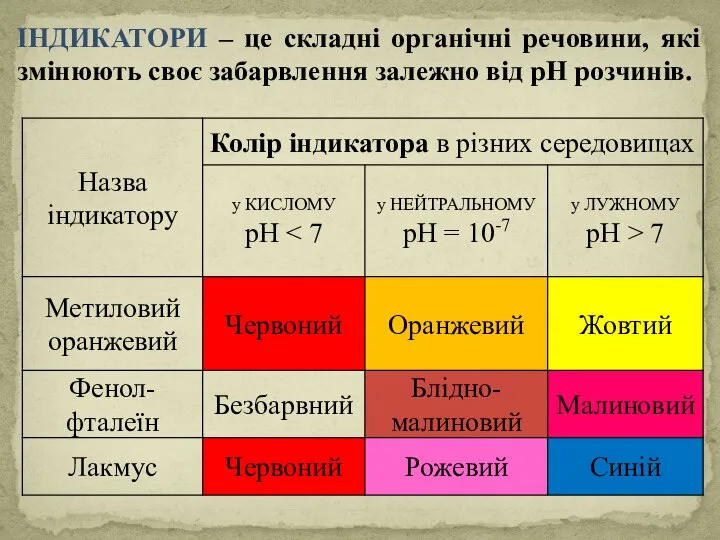
- 34. Вимірювання pH Індикатори pH - метри
- 35. ІНДИКАТОРИ – це складні органічні речовини, які змінюють своє забарвлення залежно від рН розчинів.
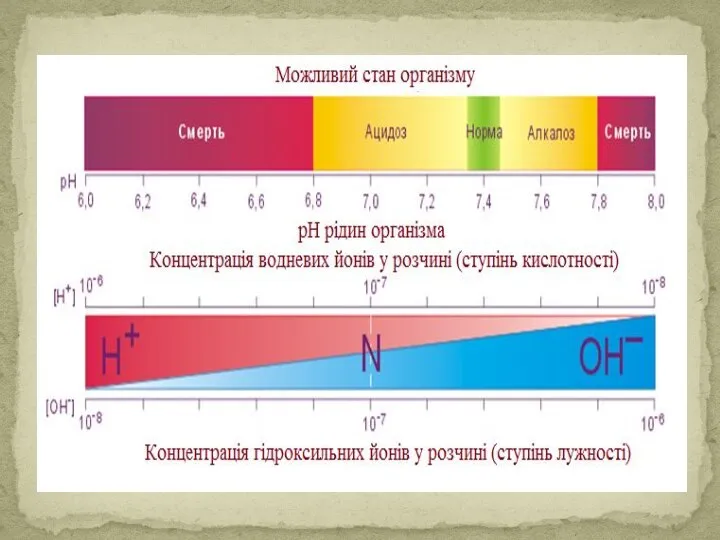
- 36. pH біологічних рідин
- 37. Сталість концентрації електролітів у біологічних рідинах, тобто водно – електролітний баланс, є одною з умов гомеостазу.
- 38. ВМІСТ ВОДИ: Плазма крові – 90-92% води і 8-10% сухої речовини в ембріоні – 97%, в
- 39. ЕЛЕКТРОЛІТИ В ОРГАНІЗМІ ВИКОНУЮТЬ ДУЖЕ ВАЖЛИВІ ФУНКЦІЇ: забезпечують ізоосмію та оптимальну величину йонної сили біологічних рідин;
- 40. Кислотно-основний стан організму і його порушення Ацидоз - це зменшення кислотності буферної ємності фізіологічної системи порівняно
- 41. Різні біологічні ферменти є активними тільки при певних значеннях рН. Зміна реакції крові на декілька десятих
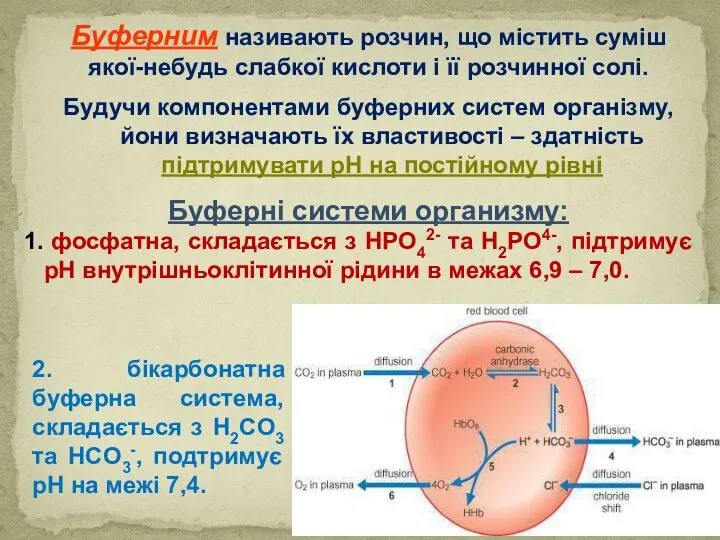
- 43. Буферним називають розчин, що містить суміш якої-небудь слабкої кислоти і її розчинної солі. Будучи компонентами буферних
- 44. Вони характеризуються різною буферною ємністю та вмістом у фізіологічних рідинах. У плазмі крові функціонують гідрогенкарбонатна, фосфатна
- 45. Класифікація буферних систем слабку кислоту і сіль цієї кислоти, утворену сильною основою, СН3СООН + СН3СОONа (ацетатний
- 46. Рівняння Гендерсона - Гассельбаха рН = рКа – lg [кислота ] [основа ] рН = рКа
- 47. МЕХАНІЗМ ДІЇ ГІДРОГЕНКАРБОНАТНОЇ БУФЕРНОЇ СИСТЕМИ Основні компоненти буферної системи: [ NaНСО3] : [ Н2СО3] = 20
- 48. CO2, що при цьому утворився, вилучається через легені, і співвідношення лужної та кислої частини буферної системи
- 49. МЕХАНІЗМ ДІЇ ФОСФАТНОЇ БУФЕРНОЇ СИСТЕМИ Основні компоненти буферної системи: Na2HPO4 – гідрогенфосфат натрію (виконує функцію солі
- 50. МЕХАНІЗМ ДІЇ БІЛКОВОЇ БУФЕРНОЇ СИСТЕМИ Складається з альбумінів, що містяться в плазмі крові. Механізм буферної дії
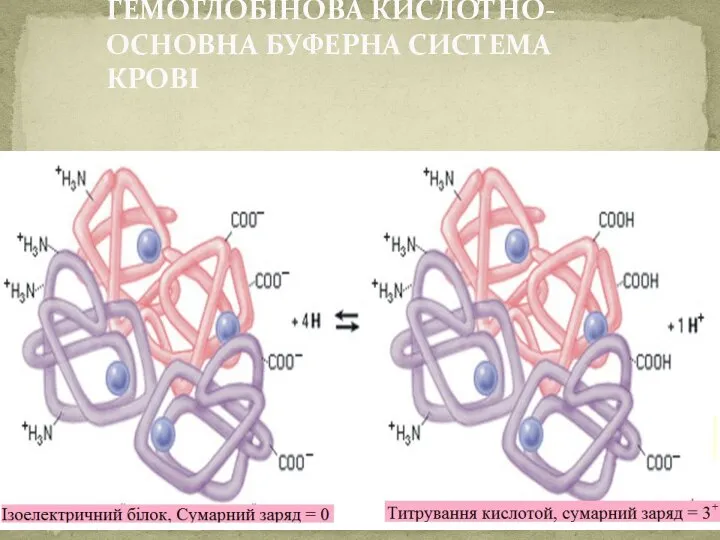
- 51. Механізм дії гемоглобінової буферної системи. Основні компоненти буферної системи: Складається з протеїнів, тобто відновленої та окисленої
- 52. ГЕМОГЛОБІНОВА КИСЛОТНО-ОСНОВНА БУФЕРНА СИСТЕМА КРОВІ
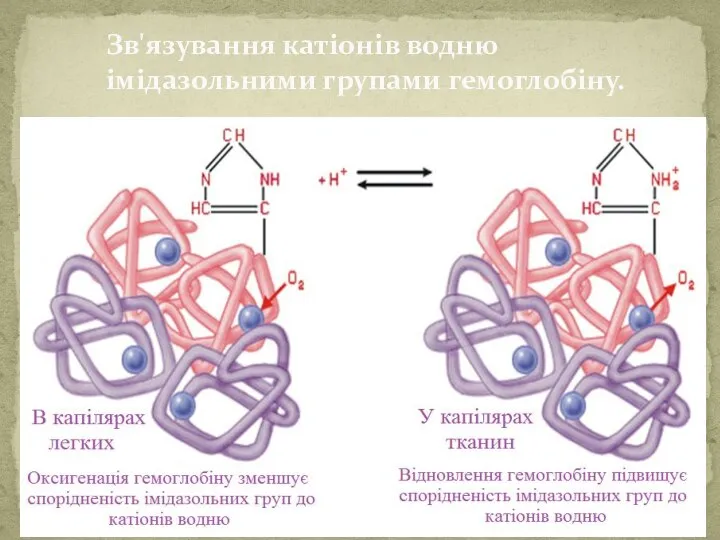
- 53. Зв'язування катіонів водню імідазольними групами гемоглобіну.
- 54. Наявність таких буферних систем в організмі дозволяє нам переносити кислі і лужні продукти, які нейтралізуються і
- 55. Ацетатний буферний розчин (рН 3,7-5,6) СН3СООNa → СН3СОО- + Na+ СН3СООH ↔ СН3СОО- + H+ Константа
- 56. Механізм буферної дії ацетатного буфера СН3СООNa →СН3СОО- + Na+ (повністю дисоціює) СН3СООH ↔ СН3СОО- + H+
- 57. Вплив розведення на рН буферних розчинів З рівняння Гендерсона-Гассельбаха видно, що при розведенні розчинів концентрації двох
- 58. Буферна ємність Буферна ємність (В) - це число молей еквівалента сильної кислоти або лугу, яку необхідно
- 59. Буферна ємність Буферна ємність максимальна при відношенні кислоти та солі 1:1 => pH = pK. Хороша
- 61. Скачать презентацию


























![Водневий показник рН = -lg[H+] або [H+]=10-рН рН + рОН = 14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1095466/slide-32.jpg)









![Рівняння Гендерсона - Гассельбаха рН = рКа – lg [кислота ] [основа](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1095466/slide-45.jpg)
![МЕХАНІЗМ ДІЇ ГІДРОГЕНКАРБОНАТНОЇ БУФЕРНОЇ СИСТЕМИ Основні компоненти буферної системи: [ NaНСО3] :](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1095466/slide-46.jpg)










 Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Калийные удобрения
Калийные удобрения Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Белки. Структуры белков
Белки. Структуры белков Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений α-карбин и β-карбин
α-карбин и β-карбин Химия в загадках
Химия в загадках Алюминий. 9 класс
Алюминий. 9 класс Сульфаниламидные препараты. Хинолоны
Сульфаниламидные препараты. Хинолоны Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Физическая химия, термодинамика
Физическая химия, термодинамика Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Растворы, растворимость
Растворы, растворимость Алкины
Алкины Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Разбор заданий
Разбор заданий Введение в органическую химию
Введение в органическую химию Химический алфавит. Алфавит
Химический алфавит. Алфавит Практические задания по химии
Практические задания по химии Туф вулканический
Туф вулканический Химик (Химическая реакция реакция или химическое явление)
Химик (Химическая реакция реакция или химическое явление) Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Мышьяк
Мышьяк Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Презентация на тему Жидкие кристаллы
Презентация на тему Жидкие кристаллы