Содержание
- 2. Условные константы устойчивости комплексонатов учитывают все возможные побочные реакции
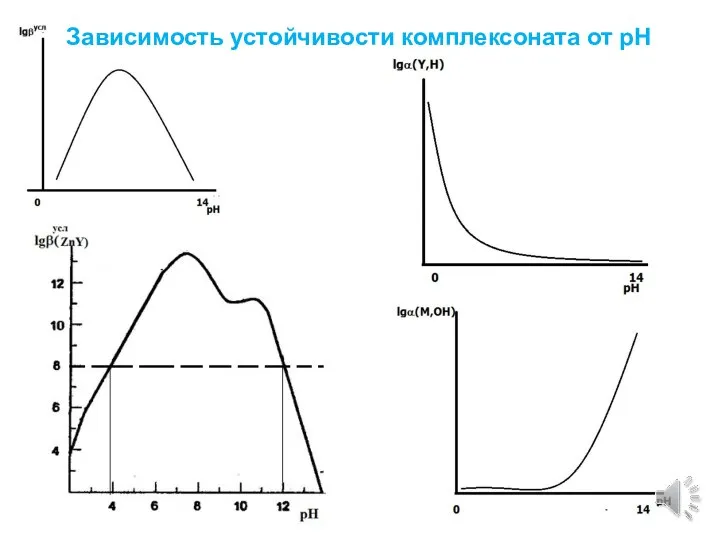
- 3. Зависимость устойчивости комплексоната от рН
- 4. Пример. Определите минимальное значение рН для комплексонометрического титирования La3+. Значение логарифма термодинамической константы устойчивости комплексоната лантана:
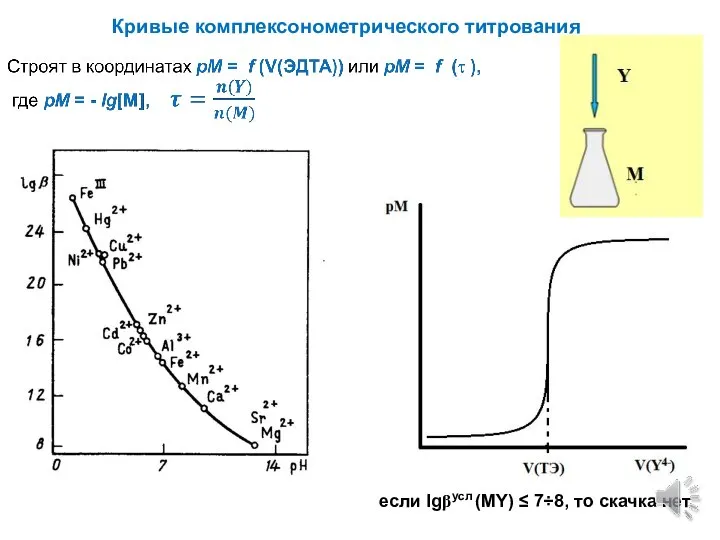
- 5. Кривые комплексонометрического титрования если lgβусл (MY) ≤ 7÷8, то скачка нет
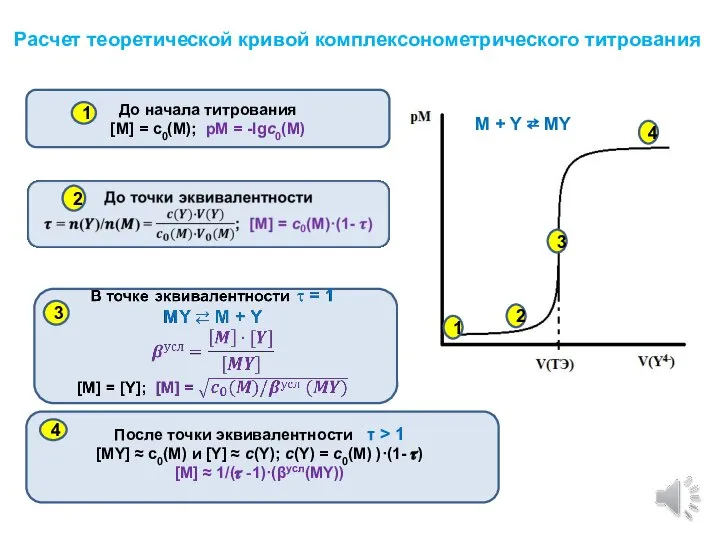
- 6. Расчет теоретической кривой комплексонометрического титрования
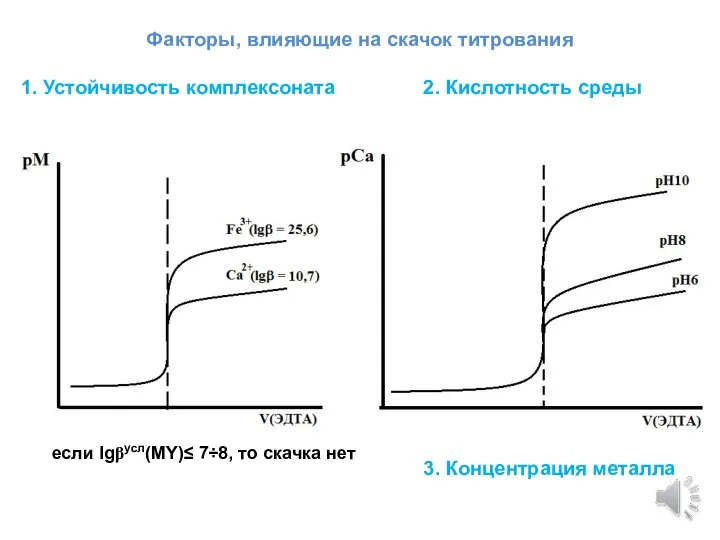
- 7. Факторы, влияющие на скачок титрования 1. Устойчивость комплексоната 2. Кислотность среды если lgβусл(MY)≤ 7÷8, то скачка
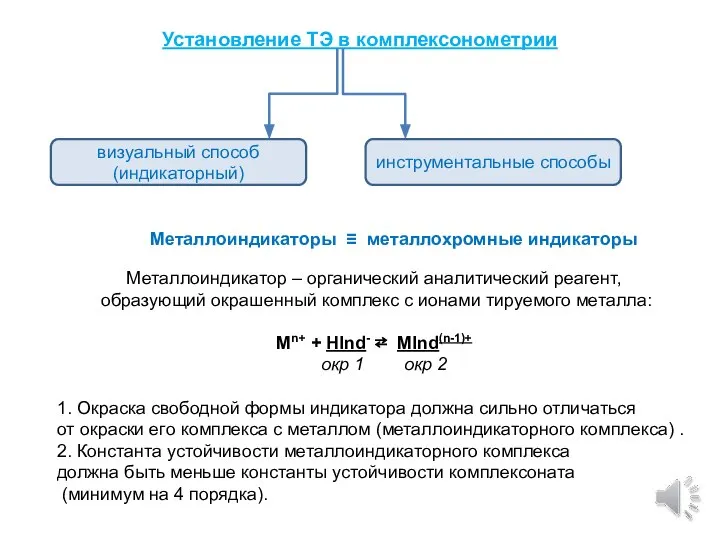
- 8. Установление ТЭ в комплексонометрии инструментальные способы визуальный способ (индикаторный) Металлоиндикаторы ≡ металлохромные индикаторы Металлоиндикатор – органический
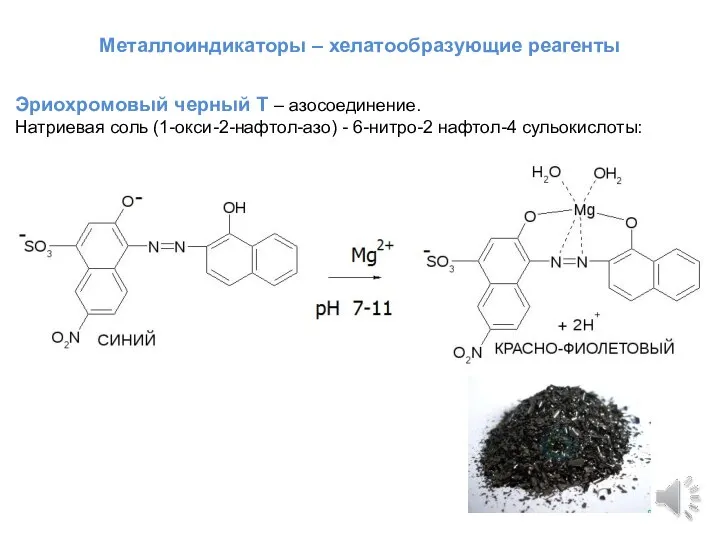
- 9. Металлоиндикаторы – хелатообразующие реагенты Эриохромовый черный Т – азосоединение. Натриевая соль (1-окси-2-нафтол-азо) - 6-нитро-2 нафтол-4 сульокислоты:
- 10. Ксиленоловый оранжневый – краситель трифенилметанового ряда. 3,3,- бис/ – [N,N/ -ди-(карбоксиметил)]-аминометил-о-крезолсульфофталеин
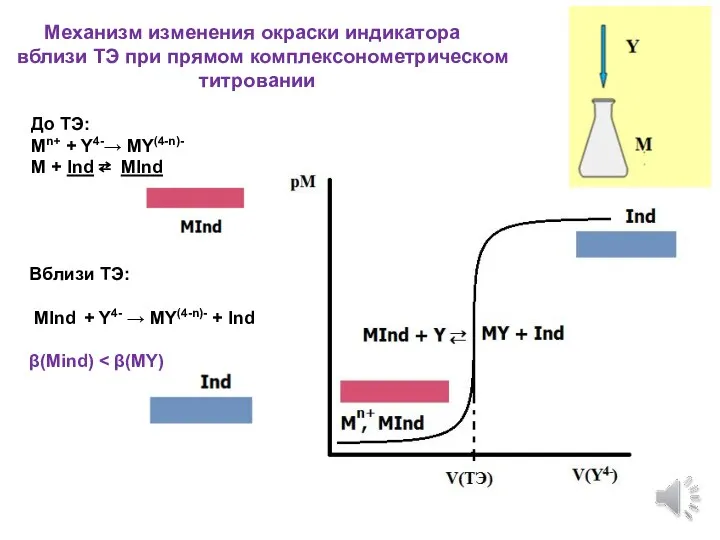
- 11. Механизм изменения окраски индикатора вблизи ТЭ при прямом комплексонометрическом титровании До ТЭ: Mn+ + Y4-→ MY(4-n)-
- 12. Правило выбора металлоиндикатора
- 14. Скачать презентацию


![Ксиленоловый оранжневый – краситель трифенилметанового ряда. 3,3,- бис/ – [N,N/ -ди-(карбоксиметил)]-аминометил-о-крезолсульфофталеин](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1114323/slide-9.jpg)

 Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау
Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау Алгоритмы при изучении химии
Алгоритмы при изучении химии Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Выращивание кристаллов
Выращивание кристаллов Карбоновые кислоты
Карбоновые кислоты Самостоятельная работа
Самостоятельная работа Химия неорганическая и органическая
Химия неорганическая и органическая Азотная кислота и её соли. Бесцветная жидкость. HNO3
Азотная кислота и её соли. Бесцветная жидкость. HNO3 Ферменты
Ферменты Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Викторина Важнейшие классы веществ. Химические реакции. 8 класс
Викторина Важнейшие классы веществ. Химические реакции. 8 класс Биологические буферные системы
Биологические буферные системы Ковалентная неполярная связь
Ковалентная неполярная связь Презентация на тему Таблица Менделеева внутри нас
Презентация на тему Таблица Менделеева внутри нас  Фосфориты. Добыча фосфоритов
Фосфориты. Добыча фосфоритов хим связь
хим связь Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Карбоновые кислоты
Карбоновые кислоты d-элементы.Распространение в природе и основные материалы
d-элементы.Распространение в природе и основные материалы Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Ситалл – искусственный поликристаллический материал
Ситалл – искусственный поликристаллический материал Сероводород. Соединения серы
Сероводород. Соединения серы Происхождения названий химических элементов
Происхождения названий химических элементов Бутлєров
Бутлєров Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ Виды каталитических ядов и способы их устранения
Виды каталитических ядов и способы их устранения Влияние давления на процессы абсорбция и деборция
Влияние давления на процессы абсорбция и деборция