Содержание
- 2. Определение Кислоты – это сложные вещества, в состав которых входят атомы водорода и кислотный остаток. Общая
- 3. Кислотный остаток Дать определение кислотам. 1.В данном ряду найдите формулу кислоты. Поясните. КОН, CuО, Н2СО3, Nа3РО4
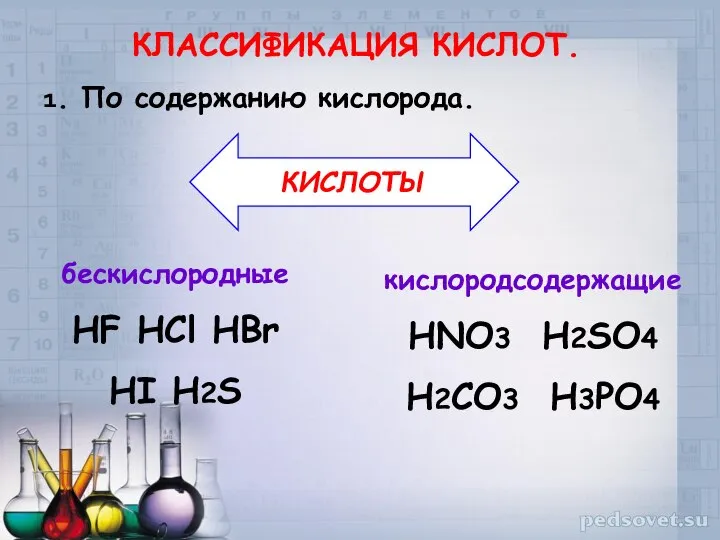
- 4. КЛАССИФИКАЦИЯ КИСЛОТ. бескислородные HF HCl HBr HI H2S 1. По содержанию кислорода. кислородсодержащие HNO3 H2SO4 H2CO3
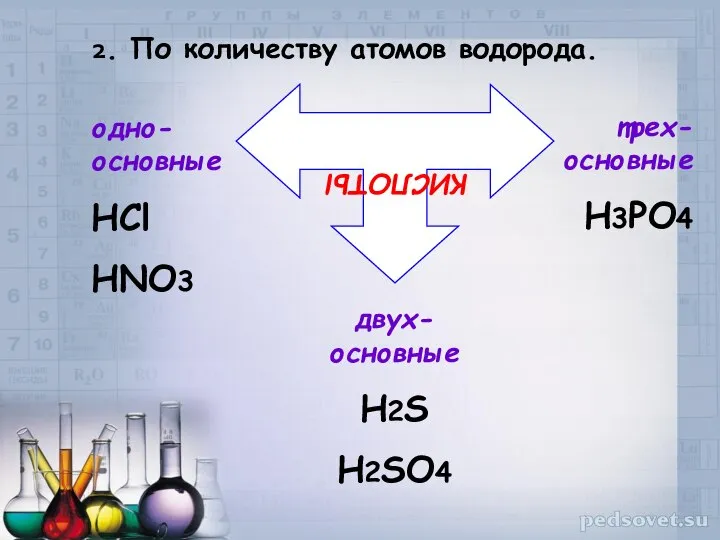
- 5. 2. По количеству атомов водорода. КИСЛОТЫ одно-основные HCl HNO3 двух-основные H2S H2SO4 трех-основные H3PO4
- 6. Порядок названий кислот: 1. Каждой кислоте соответствует свой кислотный оксид. 2. При этом валентность центрального атома
- 7. Названия кислот и соответствующим им солям
- 8. Названия кислот и соответствующим им солям
- 9. Физические свойства кислот При обычных условиях кислоты могут быть твердыми и жидкими. Кислоты –едкие жидкости (кроме
- 10. Получение: Бескислородные кислоты получают: Взаимодействием неметалла с водородом: Н2 + Сl2 = 2HCl Действием на соль
- 11. Получение: Кислородсодержащие кислоты можно получить: Взаимодействием кислотных оксидов с водой (кроме оксида кремния (IV)): Р2О5 +
- 12. Химические свойства кислот 1. Универсальный индикатор - розовый
- 13. Химические свойства кислот: 2. Взаимодействие с металлами: Правило: Металлы, стоящие в ряду активности металлов до Н,
- 14. Химические свойства кислот 3. Взаимодействие с основными оксидами: Правило:При взаимодействии основных оксидов с кислотами, образуется соль
- 15. Химические свойства кислот 4. Взаимодействие кислот с основаниями: Правило: При взаимодействии растворимых и нерастворимых оснований с
- 16. Химические свойства кислот 5. Взаимодействие с солями Правило: Более сильная кислота, вытесняет менее сильную из ее
- 17. Химические свойства кислот Для того, чтоб кислота прореагировала с солью, нужно чтоб она была сильнее той,
- 18. 1. Формулы, каких веществ «лишние» и почему? 1)HCI 2)CO2 3)NaOH 4) H2SO4 5) NaCI 6) H3PO4
- 19. Названия H2SO4 HNO3 H3PO4 ФОСФОРНАЯ СЕРНАЯ АЗОТНАЯ H2СО3 УГОЛЬНАЯ HСl СОЛЯНАЯ Соотнесите формулы и названия кислот
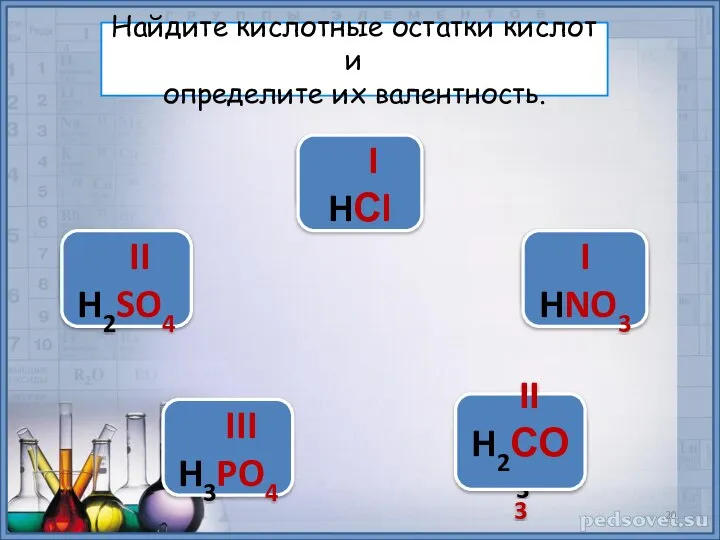
- 20. H2SO4 HNO3 H3PO4 H2СО3 HСl Найдите кислотные остатки кислот и определите их валентность. I HСl I
- 21. Закрепление: Составьте формулы солей: Нитрата свинца (II) Сульфата натрия Карбоната кальция Фосфата калия Сульфита алюминия Хлорида
- 22. Закрепление: С какими из перечисленных веществ будет взаимодействовать соляная кислота: оксид углерода (IV), сульфид калия, оксид
- 24. Скачать презентацию


















 Количество вещества. Решение задач
Количество вещества. Решение задач Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Сравнение активностей металлов
Сравнение активностей металлов Кремнийорганическая гипотеза
Кремнийорганическая гипотеза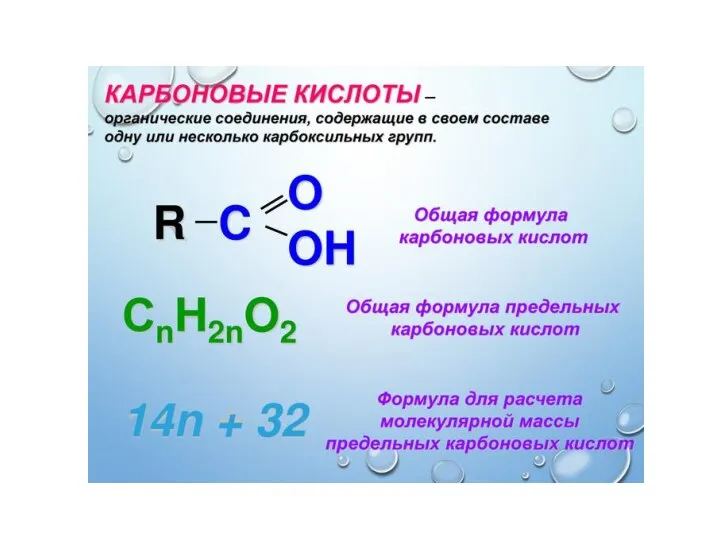 Карбоновые кислоты
Карбоновые кислоты Гидроксиды металлов
Гидроксиды металлов Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Химический диктант по органической химии. 9 класс
Химический диктант по органической химии. 9 класс Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты  Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Общие физические и химические свойства металлов. 9 класс
Общие физические и химические свойства металлов. 9 класс Важнейшие соединения хлора
Важнейшие соединения хлора Неметаллы и их соединения
Неметаллы и их соединения Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Углеводы. Дисахариды. Полисахариды. Лекция 6
Углеводы. Дисахариды. Полисахариды. Лекция 6 Химия и жизнь
Химия и жизнь Тяжелая вода
Тяжелая вода География. Уральские самоцветы
География. Уральские самоцветы Активность каталазы
Активность каталазы Общие вопросы материаловедения
Общие вопросы материаловедения Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. Основания, их классификация и свойства
Основания, их классификация и свойства Дизельное топливо
Дизельное топливо електроліти та неелектроліти
електроліти та неелектроліти Составление уравнений химических реакций. Решение упражнений по теме
Составление уравнений химических реакций. Решение упражнений по теме