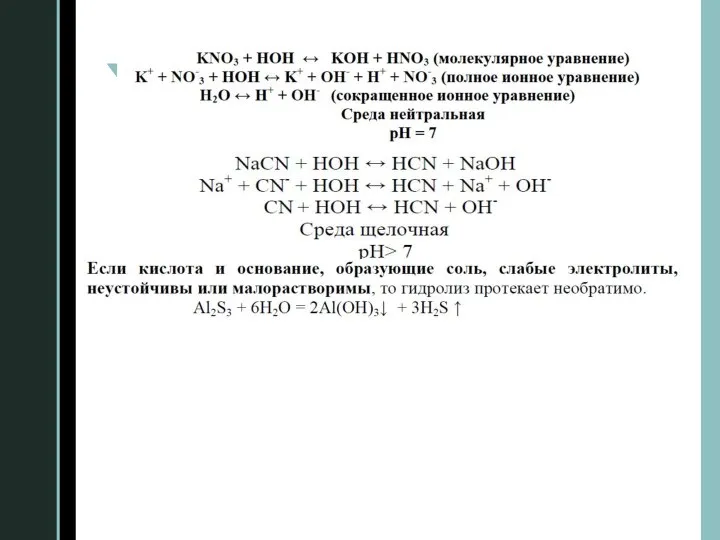
Слайд 31. Реакции ионного обмена
Реакции, протекающие в растворах электролитов между ионами, называются реакциями

ионного обмена.
Реакции ионного обмена могут быть обратимыми и необратимыми.
Необратимыми называются реакции между сильными электролитами, в результате которых образуются:
1.Малодиссоциирующее вещество. например – вода.
2.Малорастворимое вещество.
3.Газообразное или летучее вещество.
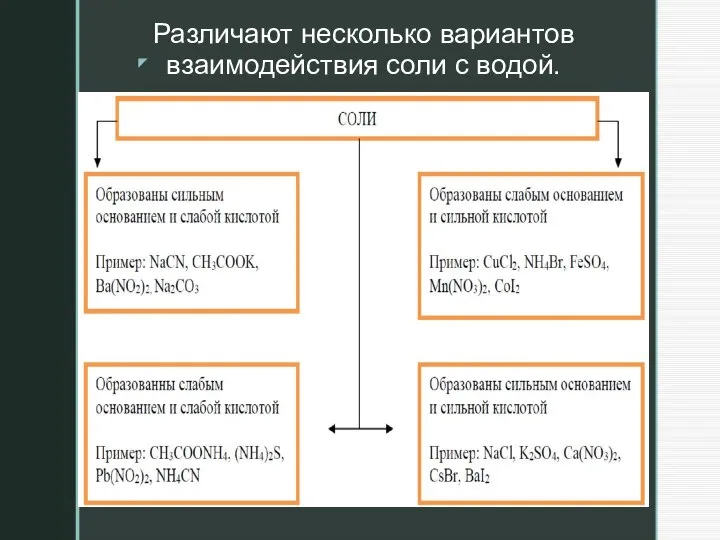
Слайд 10Различают несколько вариантов взаимодействия соли с водой.
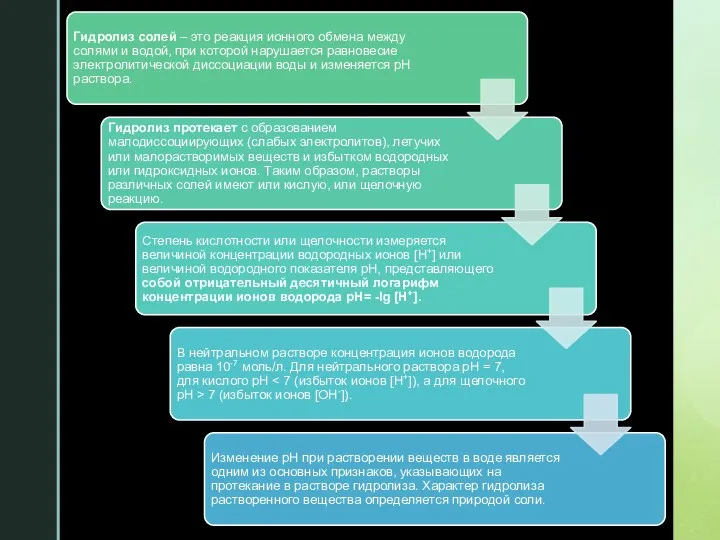
Слайд 123. Степень и константа гидролиза.

Слайд 13Степень гидролиза зависит от следующих факторов:
1. От природы соли. Чем слабее кислота

или основание, из которых образована соль, тем больше степень гидролиза.
2. От концентрации соли. Степень гидролиза увеличивается с разбавлением раствора соли.
3. От температуры. Степень гидролиза солей возрастает с повышением температуры, т. к. увеличивается степень диссоциации соли и воды.
Таким образом, для увеличения степени гидролиза следует растворы разбавлять и нагревать. Для подавления гидролиза нужно проводить процессы на холоде и с меньшим количеством воды.
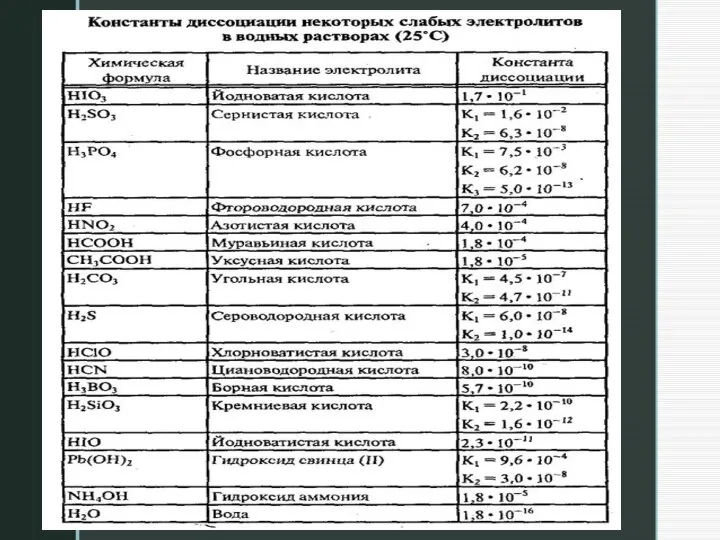
Слайд 14Константа гидролиза – постоянная величина и не зависит от концентрации ионов в

растворе. Она характеризует способность данной соли подвергаться гидролизу: чем больше Kг, тем в большей степени протекает гидролиз.
Гидролиз соли сильного основания и слабой кислоты,
Кг =
Слайд 15Для процесса гидролиза действует закон разбавления Оствальда, согласно которому по мере разбавления

раствора соли степень гидролиза увеличивается
х - степень гидролиза
Для гидролиза соли слабого основания и сильной кислоты константа гидролиза определяется по формуле:
Кг=
Для гидролиза соли слабого основания и слабой кислоты константа гидролиза определяется по формуле:
Кг =
Слайд 17Пример:
Вычислите константу гидролиза хлорида аммония, степень гидролиза в 0,1 М растворе и

pH этого раствора. По результатам вычислений сделайте вывод.
1) Записываем уравнение гидролиза в молекулярном и ионном виде:
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + H2O ↔ NH4OH + H+
и выражение константы гидролиза
Кг =
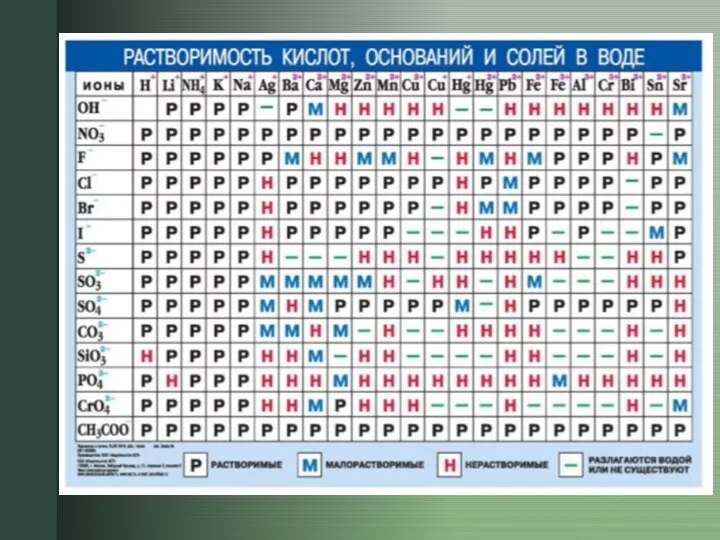
2) Для расчета константы гидролиза используем формулу для соли, образованной слабым основанием и сильной кислотой, используем справочные данные (талице, в конце лекции):
Кг =
3) По закону разбавления Оствальда вычисляем степень гидролиза:
хг =
4) Рассчитываем концентрацию ионов водорода:
[H+] = хг∙С = 7,5∙10–5× 0,1 = 7,5×10–6
5) Вычисляем водородный показатель раствора:
pH = –lg[H+] = –lg(7,5×10–6) = 5,1
Из полученных результатов следует, что гидролиз хлорида аммония протекает в незначительной степени, но, тем не менее, среда раствора кислая.











 Термокаталитические процессы переработки нефтяных фракций
Термокаталитические процессы переработки нефтяных фракций Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий Азот
Азот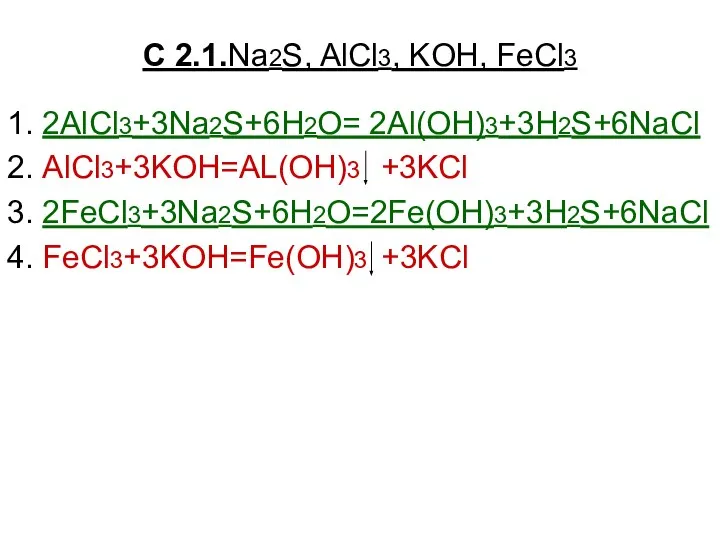 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Техника безопасности на уроках химии
Техника безопасности на уроках химии 12_BROMATOMETRIYa_NITRITOMETRIYa
12_BROMATOMETRIYa_NITRITOMETRIYa Электролиз
Электролиз Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Малотоннажные термопласты
Малотоннажные термопласты Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Определение Кофеина в Кофе
Определение Кофеина в Кофе Быстрорастущие кристаллы
Быстрорастущие кристаллы ВПР – это интересно
ВПР – это интересно Дождь из облака
Дождь из облака Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Идентификация органических соединений
Идентификация органических соединений khim
khim Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Белки. Структуры белков
Белки. Структуры белков Ионные реакции
Ионные реакции Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Новогодний Пробник №190415
Новогодний Пробник №190415 Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ