Содержание
- 2. Определение кислоты Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе
- 3. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие
- 4. Классификация кислот По содержанию кислорода : -бескислородные(HCl, H2S); -кислородосодержащие (HNO3,H2SO4). 2. По основности — количество кислых
- 5. 6. По летучести : -Летучие (H2S, HCl); -Нелетучие (H2SO4) ; 7.По растворимости в воде -Растворимые (H2SO4);
- 6. Химические свойства Взаимодействие с амфотерными оксидами с образованием соли и воды: Взаимодействие со щелочами с образованием
- 7. С азотной кислотой и концентрированной серной кислотами реакция идёт иначе: Для органических кислот характерна реакция этерификации
- 8. Главная Неорганические кислоты Азотистая кислота Азотная кислота Борная кислота Бромоводородная кислота Йодоводородная кислота Йодноватая кислота Иодная
- 10. Скачать презентацию
Слайд 2Определение кислоты
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических
Определение кислоты
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических

В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют.
По теории сольвосистем, начало которой положили работы американских химиков Кэди и Франклина, опубликованные в1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О+, NH4+). Это определение хорошо тем, что не привязано к водным растворам.
По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским
учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты —
водородсодержащие вещества, отдающие при реакциях положительные ионы
водорода — протоны.
Главная
ДАЛЕЕ >>>
Слайд 3Слабость этой теории в том, что она не включает в себя не
Слабость этой теории в том, что она не включает в себя не

По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар. Таким образом, в теории Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью.
Пирсон модифицировал теорию Льюиса с учётом характеристик орбиталей-акцепторов, введя понятие жёстких и мягких кислот и оснований (принцип Пирсона или принцип ЖМКО). Жёсткие кислоты характеризуются высокой электроотрицательностью и низкой поляризуемостью атома, несущего свободную орбиталь, мягкие кислоты, соответственно, характеризуются низкой электроотрицательностью и высокой поляризуемостью атома, несущего свободную орбиталь.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Главная
Главная
<<<НАЗАД
Слайд 4Классификация кислот
По содержанию кислорода :
-бескислородные(HCl, H2S);
-кислородосодержащие (HNO3,H2SO4).
2. По основности — количество кислых атомов водорода:
-Одноосновные (HNO3);
-Двухосновные
Классификация кислот
По содержанию кислорода :
-бескислородные(HCl, H2S);
-кислородосодержащие (HNO3,H2SO4).
2. По основности — количество кислых атомов водорода:
-Одноосновные (HNO3);
-Двухосновные

-Трёхосновные (H3PO4, H3BO3).
-Полиосновные (практически не встречаются).
3. По силе :
-Сильные — диссоциируют практически полностью, константы -диссоциации больше 1·10−3 (HNO3);
-Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
4. По устойчивости :
-Устойчивые (H2SO4);
-Неустойчивые (H2CO3).
5. По принадлежности к классам химических соединений :
-Неорганические (HBr);
-Органические (HCOOH,CH3COOH);
Главная
ДАЛЕЕ >>>
Слайд 56. По летучести :
-Летучие (H2S, HCl);
-Нелетучие (H2SO4) ;
7.По растворимости в воде
-Растворимые (H2SO4);
-Нерастворимые (H2SiO3);
Главная
<<<НАЗАД
6. По летучести :
-Летучие (H2S, HCl);
-Нелетучие (H2SO4) ;
7.По растворимости в воде
-Растворимые (H2SO4);
-Нерастворимые (H2SiO3);
Главная
<<<НАЗАД

Слайд 6Химические свойства
Взаимодействие с амфотерными оксидами с образованием соли и воды:
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если
Химические свойства
Взаимодействие с амфотерными оксидами с образованием соли и воды:
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если
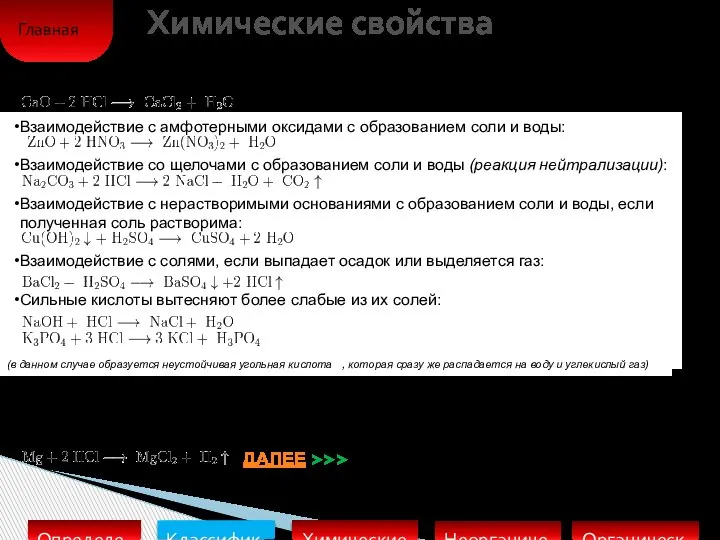
полученная соль растворима:
Взаимодействие с солями, если выпадает осадок или выделяется газ:
Сильные кислоты вытесняют более слабые из их солей:
Взаимодействие с основными оксидами с образованием соли и воды:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты ), если образующаяся соль растворима:
Главная
ДАЛЕЕ >>>
Слайд 7С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного

Например,
Главная
<<<НАЗАД
Слайд 8Главная
Неорганические кислоты
Азотистая кислота
Азотная кислота
Борная кислота
Бромоводородная кислота
Йодоводородная кислота
Йодноватая кислота
Иодная кислота
Серная кислота
Соляная кислота
Селеновая кислота
Ортофосфорная
Главная
Неорганические кислоты
Азотистая кислота
Азотная кислота
Борная кислота
Бромоводородная кислота
Йодоводородная кислота
Йодноватая кислота
Иодная кислота
Серная кислота
Соляная кислота
Селеновая кислота
Ортофосфорная
Ортокарбоновая кислота
Сернистая кислота
Сероводородная кислота
Фтороводородная кислота
Хлорноватистая кислота
Хлорноватая кислота
Хлористая кислота
Хлорная кислота
Кремниевая кислота
Марганцовая кислота
Угольная кислота
Синильная кислота
Плавиковая кислота
Роданистоводородная кислота
Тиосерная кислота
Мышьяковая кислота
Молибденовая кислота
Технециевая кислота (пертехнециевая кислота)
Полониевая кислота
Плутониевая кислота (H2PuO4)
Метафосфорная кислота
Хромовая кислота
 Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия
Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка
Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка Водопроводная вода и её фильтрация
Водопроводная вода и её фильтрация Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Презентация на тему Н.Н. Зинин
Презентация на тему Н.Н. Зинин  Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Алкины
Алкины Альдегиды
Альдегиды Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Растворы. Процесс растворения (1)
Растворы. Процесс растворения (1) Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Амины. Способы получения
Амины. Способы получения Понятие о спиртах
Понятие о спиртах Метод валентных связей
Метод валентных связей Органическая химия
Органическая химия Нефть: история и ее применение
Нефть: история и ее применение Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Химическая связь
Химическая связь Химия и география. Викторина
Химия и география. Викторина Фенол. Классификация фенолов
Фенол. Классификация фенолов Образование растворов ВМС
Образование растворов ВМС Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Сера и её соединения
Сера и её соединения Современные инновации в области химической промышленности и пути её развития
Современные инновации в области химической промышленности и пути её развития