Содержание
- 2. Цель урока Углубить понятие «скорость химической реакции» Экспериментально выяснить, как влияют на скорость химической реакции температура
- 3. Химическая разминка По фазовому составу химические реакции делятся на … и … .
- 4. Химическая разминка Гомогенные реакции - …… Гетерогенные реакции - …..
- 5. Химическая разминка Формула v =∆C/∆t отражает скорость … реакции, где ∆C - … , ∆t -
- 6. Химическая разминка Исходя из теории столкновений, объясните, почему протекают химические реакции? Почему спирт в спиртовке не
- 7. Химическая разминка Какие факторы оказывают влияние на скорость химической реакции?
- 8. Химическая разминка Даны уравнения химических реакций а) 2Na + 2H2O = 2NaOH + H2 б) Ca
- 9. Химическая разминка Какая реакция, уравнения которых приведены, пойдет с большей скоростью? Почему? СаСО3(крошка) + 2HCl =
- 10. Химическая разминка Скорость какой из приведенных реакций возрастет при повышении давления? Почему? а) Fe(T) + S(T)
- 11. Влияние температуры на скорость химической реакции Подчиняется правилу Вант – Гоффа Повышение температуры на каждые 10оС,
- 12. Правила техники безопасности Проводите опыты только с веществами, указанными учителем; Берите порции веществ, указанные учителем; Нагревание
- 13. Задача на применение знаний Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10°
- 14. самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции
- 15. Влияние катализатора на скорость химических реакций Что такое катализатор и каталитические реакции? Приведите примеры каталитических реакций
- 16. Самопроверка Катализаторы – вещества, участвующие в химической реакции и изменяющие ее скорость, но по окончании реакции
- 17. Выводы по уроку Для того, чтобы произошла химическая реакция, необходимо, чтобы частицы реагентов эффективно столкнулись, преодолев
- 19. Скачать презентацию
















 Формы существования химических элементов. Формы существования химических элементов
Формы существования химических элементов. Формы существования химических элементов Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Калифорний Cf
Калифорний Cf Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Биологические буферные системы
Биологические буферные системы Причины многообразия веществ. 11 класс
Причины многообразия веществ. 11 класс Ионные уравнения реакций
Ионные уравнения реакций Сложные реакции
Сложные реакции Melatonin. Краткий экскурс
Melatonin. Краткий экскурс Сера. Немного истории
Сера. Немного истории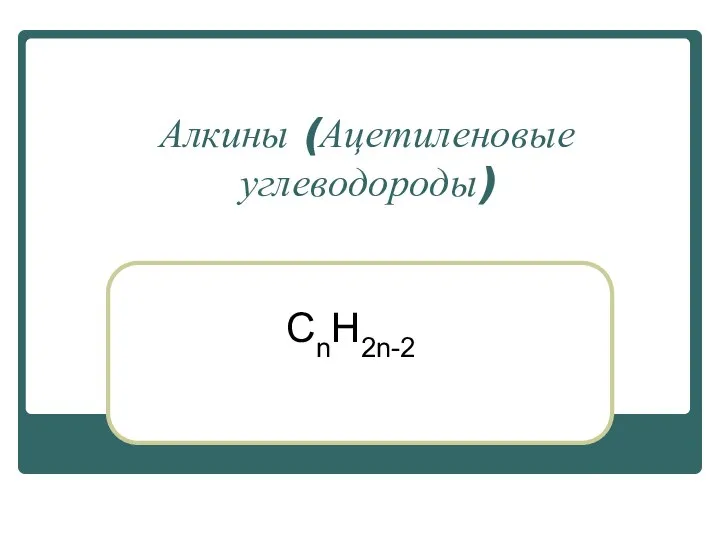 Алкины (Ацетиленовые углеводороды)
Алкины (Ацетиленовые углеводороды) Нефть
Нефть Виды химических связей
Виды химических связей Кислоты. Оксиды
Кислоты. Оксиды Растворы. 11 класс
Растворы. 11 класс Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы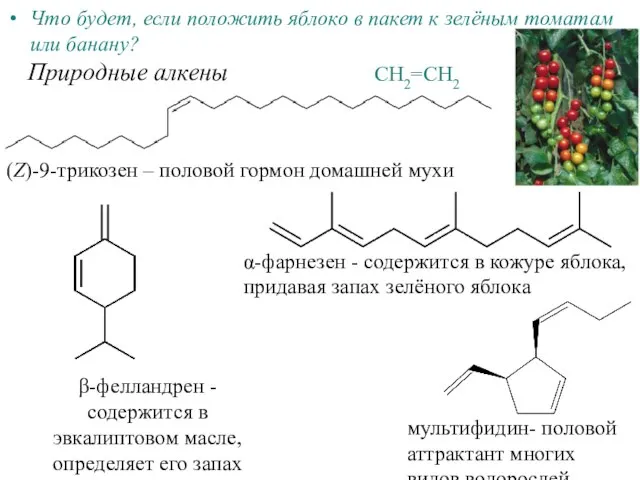 Алкены
Алкены Галогены – химические элементы
Галогены – химические элементы Уравнения диссоциации
Уравнения диссоциации Осаждение нитрида кремния
Осаждение нитрида кремния Химический состав клетки
Химический состав клетки Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Нуклеиновые кислоты
Нуклеиновые кислоты Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)
Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)