Содержание
- 2. Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с образованием катионов водорода
- 3. Классификация кислот
- 4. Химические свойства кислот Диссоциация; Взаимодействие с индикаторами; с металлами; с основными оксидами; с основаниями; с солями
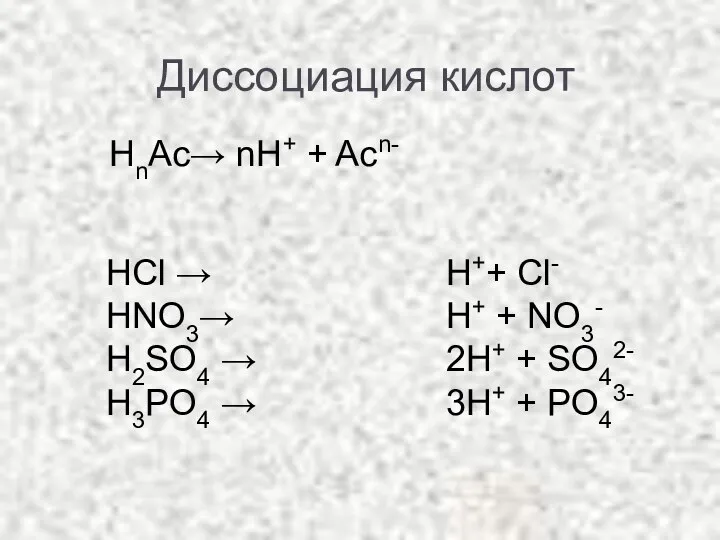
- 5. Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnАс→ nН+ + Acn- H++ Cl- H+
- 6. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 7. Взаимодействие с металлами Ме + НnAc → МеnAcm+ Н2 металл + кислота→соль + водород 2 Al
- 8. Взаимодействие с основными оксидами МеxOy + HnAc → МеnAcy + H2O Основный оксид + кислота →
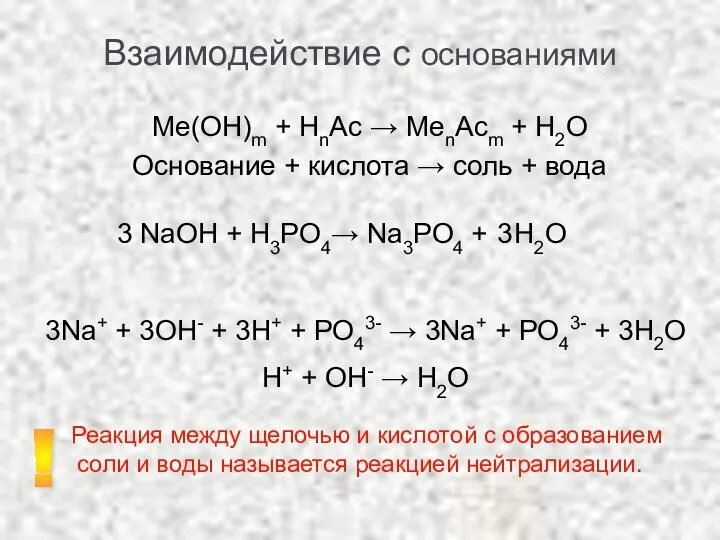
- 9. Взаимодействие с основаниями Ме(ОН)m + НnAc → MenAcm + H2O Основание + кислота → соль +
- 10. Взаимодействие с солями МеxAcy + HnAc → HхAc + МеnAcy Соль + кислота → новая кислота
- 11. Лимонная кислота содержится в лимонах. Яблочная- в яблоках. Щавелевая - в листьях щавеля. Муравьиная содержится в
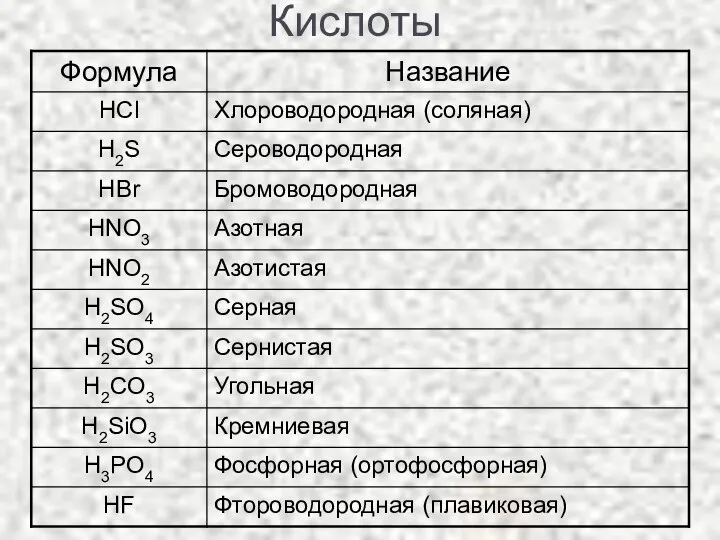
- 12. Кислоты
- 13. Представители кислот Серная кислота Н2SО4 бесцветная вязкая жидкость, без запаха ,тяжелее воды, поглощает влагу из воздуха
- 15. Скачать презентацию









 Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Классификация органических соединений
Классификация органических соединений 564481
564481 Разбор заданий
Разбор заданий Минеральные продукты
Минеральные продукты Пищевые кислоты
Пищевые кислоты Введение в биохимию
Введение в биохимию Углеволокно (карбон)
Углеволокно (карбон) Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Презентация на тему Ионы и ионная химическая связь
Презентация на тему Ионы и ионная химическая связь  Уравнение состояния идеального газа
Уравнение состояния идеального газа Химическая термодинамика
Химическая термодинамика Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Амилаза. Строение амилазы
Амилаза. Строение амилазы Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс) 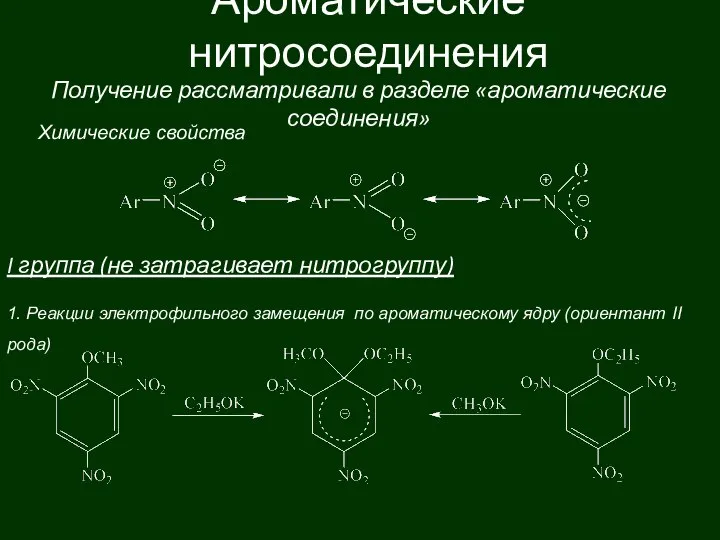 Ароматические нитросоединения
Ароматические нитросоединения Диспропроциялану реакциялары
Диспропроциялану реакциялары АРЕНЫ
АРЕНЫ Классификация химических элементов
Классификация химических элементов Железо в организме человека. Функции железа в организме
Железо в организме человека. Функции железа в организме Фосфор
Фосфор Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Структура периодической таблицы элементов
Структура периодической таблицы элементов Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Химические Недотроги
Презентация на тему Химические Недотроги