Слайд 2гемоглобиновый буфер:
где
HHb — дезоксигемоглобин;
HHbO2 — оксигемоглобин;
KHb — калиевая соль дезоксигемоглобина;
KHbO2 — калиевая

соль оксигемоглобина
Слайд 3
Механизм действия гемоглобинового буфера
1. [общий механизм].
2. Гемоглобин является белком, он амфотерен
COO–
![Механизм действия гемоглобинового буфера 1. [общий механизм]. 2. Гемоглобин является белком, он](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/927117/slide-2.jpg)
COOH
Pt + H+ + Cl– → Pt
NH3+ NH3+Cl
COO– COONa
Pt + Na+ + OH– → Pt
NH3+ NH3+OH
3. буферная система, состоящая из оксигемоглобина и калиевой соли гемоглобина, участвует в выделении углекислоты из организма,понижая рН
По силе HHbO2 >H2CO3 > HHb.,
=== более сильная будет вытеснять более слабую из растворов ее солей:
Слайд 4В тканях и лёгких протекают следующие процессы:
1. В тканях:
KHb + H2CO3 →
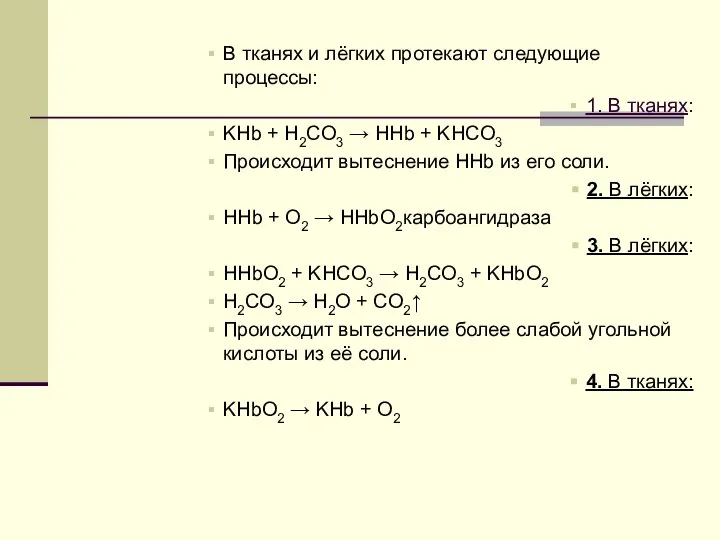
HHb + KHCO3
Происходит вытеснение HHb из его соли.
2. В лёгких:
HHb + O2 → HHbO2карбоангидраза
3. В лёгких:
HHbO2 + KHCO3 → H2CO3 + KHbO2
H2CO3 → H2O + CO2↑
Происходит вытеснение более слабой угольной кислоты из её соли.
4. В тканях:
KHbO2 → KHb + O2
Слайд 5 Перемещение ионов хлора между
эритроцитом и плазмой крови
носит название «хлоридного
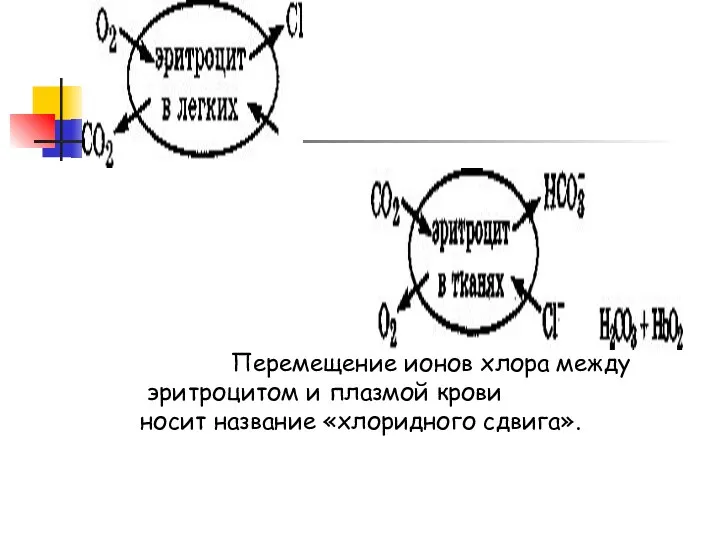
сдвига».
Слайд 6Формула бикарбонатного буфера:
[соотношение Н2СО3 к NaHCO3 1:20
Механизм действия бикарбонатного буфера

–обычный
[CO2]= 0,03 p CO2 , где p CO2 -парциальное давление;
0,03 - коэффициент растворимости CO2 в жидких средах организма;
рК/=6,1 (для крови)
Слайд 71. Главное назначение гидрокарбонатного буфера заключается в нейтрализации кислот.
2. Он является системой

быстрого и эффективного реагирования, т.к. углекислый газ - быстро выводится через легкие. Нарушение кислотно-основного равновесия в организме прежде всего компенсируется с помощью гидрокарбонатной буферной системы
(за 10—15 мин).
3. При этом изменяется отношение [НСОз-]/[Н2СОз]. Затем, за счет изменения объема легочной вентиляции, восстанавливается в течение 10—18 ч отношение [НСО3-]/[Н2СОз], соответствующее норме.
Слайд 8Фосфатный буфер имеет наибольшее значение не в крови, а в таких биологических

жидкостях, как моча и соки пищеварительных желез.
Особенностью фосфатного буфера является то, что оба его компонента являются сильными электролитами, его формула: [соотношение солей 1:4].
Слайд 9
Механизм действия фосфатного буфера:
1/ при добавлении кислоты
2 Na+ + HPO4

2– + H+ + Cl– → NaH2PO4 + Na+ + Cl–
2/ при добавлении щелочи :
NaH2PO4 + NaOH → Na2HPO4 + H2O
Избыток однозамещённого и двузамещённого фосфата удаляется через почки. полное восстановление отношения в буфере происходит только через 2—3 сут.
Слайд 10Белковый буфер [белков плазмы].
Роль кислоты в этом буфере выполняет белок
![Белковый буфер [белков плазмы]. Роль кислоты в этом буфере выполняет белок [протеин],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/927117/slide-9.jpg)
[протеин], а роль соли — соль протеина. Формула белкового буфера: .
Механизм действия:
1/ с кислотой образуются слабо диссоциирующая белок-кислота:
Pt—COONa + HCl → Pt—COOH + NaCl
2/ с щелочами идёт реакция нейтрализации:
Pt—COOH + NaOH → Pt—COONa + H2O
Кроме того, благодаря амфотерности, белковые молекулы могут связывать как кислоты
Слайд 11Кислотно-основное состояние организма и его нарушения
Ацидоз - это уменьшение кислотной буферной емкости

физиологической системы по сравнению с нормой.
Алкалоз - это увеличение кислотной буферной емкости физиологической системы по сравнению с нормой
. Экзогенный ацидоз возникает при употреблении пищи с избыточным содержанием кислот (лимонной, бензойной, уксусной), а также лекарственных средств, трансформация которых в организме способствует понижению рН среды.
Эндогенный ацидоз или алкалоз возникает при нарушении протолитического баланса в организме вследствие нарушения соотношений скоростей синтеза и выведения тех или иных кислот или оснований»
Слайд 12В зависимости от глубины патологических изменений
=======компенсированный и некомпенсированный ацидоз (алкалоз).
===При

компенсированном ацидозе (алкалозе), несмотря на отклонения от нормы кислотной буферной емкости, рН крови сохраняет значение в пределах 7,35 < рН < 7,45. =====Некомпенсированный ацидоз сопровождается уменьшением кислотной буферной емкости и снижением рН крови (6,8 < рН < 7,35), а
====некомпенсированный алкалоз - увеличением кислотной буферной емкости и повышением рН крови (7,45 < рН < 7,9).
Снижение рН крови по сравнению с нормой называется ацидемией, а повышение рН крови — алкалемией. =====Изменение значения рН крови на 0,6 единицы в любую сторону приводит к летальному исходу.
.
Слайд 13 Показатели КОС:
1.Величина рН плазмы крови - 7,35 < рН < 7,45.
2.

Парциальное напряжение углекислоты р(СО2) - парциальное давление CO2 р(СО2) = (40 ± 5) мм рт. ст.
Предельные значения парциального давления СО2 составляют при алкалозе 10 мм рт. ст., а при ацидозе 130 мм рт. ст.
3. Содержание гидрокарбоната в плазме крови в норме с(НСО3) = = (24,4 ± 3) ммоль/л.
4. Содержание буферных оснований в плазме крови (ВВ) (БО)-нормальное значение для плазмы ВВ = (42 ± 3) ммоль/л.
5. Сдвиг (Избыток или дефицит )буферных оснований в крови BE (СБО)= разнице между БО в крови у исследуемого человека и значением ВВ в
норме, равным 42 ммоль/л. В норме BE равен ±3 ммоль/л. При патологии : ±30 ммоль/л.
Слайд 14Метаболический ацидоз характеризуется избытком нелетучей кислоты или дефицитом гидрокарбонат-аниона в межклеточной жидкости.
Показатели:

Ва < норма; [донор протона] > норма; рН < норма; c(HCO3) < норма; BE < норма; р(СО2) < норма.
Причины: нарушение кровообращения, кислородное голодание тканей, диарея (понос), нарушение выделительной функции почек, диабет.
Метаболический алкалоз характеризуется удалением молекул кислот или накоплением буферных оснований, включая содержание гидрокарбонат-аниона в межклеточной жидкости.
Показатели: Ва > норма; [акцептор протона] > норма; рН > норма; с(НСОз) > норма; BE > норма; р(СО2) > норма.
Причины: неукротимая рвота, удаление кислых продуктов из желудка, запор (накопление щелочных продуктов в кишечнике), длительный прием щелочной пищи и минеральной воды.
Слайд 15Респираторный (газовый) ацидоз характеризуется пониженной скоростью вентиляции легких по сравнению со скоростью

образования метаболического СО2
Показатели: Ва < норма; [донор протона] > норма; рН < норма; с(НСОз) > норма; BE > норма; р(СО2) > норма.
Причины: заболевания органов дыхания, гиповентиляция легких, угнетение дыхательного центра некоторыми препаратами, например барбитуратами .
Респираторный (газовый) алкалоз характеризуется повышенной скоростью вентиляции легких по сравнению со скоростью образования метаболического СО2.
Показатели: Ва > норма; [донор протона] < норма; рН > норма; с(НСОз) < норма; BE < норма; р(СО2) < норма.
Причины: вдыхание разреженного воздуха, чрезмерное возбуждение дыхательного центра вследствие поражения мозга, гипервентиляция легких, развитие тепловой одышки.
Слайд 16Коррекция
При ацидозе
===в качестве экстренной меры используют внутривенное вливание растворов гидрокарбоната натрия

(по 100-200 мл 4,5 % раствора, в острых случаях до 100 мл 8,4 % раствора),
мл 5% NaНСО3 =
=== 3,66 % водный раствор трисамина H2NC(CH2OH)3
==== 11 % раствор лактата натрия.
Слайд 17Для устранения алкалоза
==== 5 % раствор аскорбиновой кислоты, частично нейтрализованный гидрокарбонатом

натрия до рН = 6,0-7,0.
====вдыхание смеси с повышенным содержанием углекислого газа, приём через рот
==== капельно растворов хлорида аммония,
====После еды при метаболическом алкалозе можно назначать внутрь 1% раствор HCl [всего 0,5 г].

![Механизм действия гемоглобинового буфера 1. [общий механизм]. 2. Гемоглобин является белком, он](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/927117/slide-2.jpg)






![Белковый буфер [белков плазмы]. Роль кислоты в этом буфере выполняет белок [протеин],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/927117/slide-9.jpg)







 Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Ортофосфорная кислота
Ортофосфорная кислота Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных
Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Презентация на тему Сахароза
Презентация на тему Сахароза  Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Получение метанола из синтез-газа
Получение метанола из синтез-газа Карбоновые кислоты
Карбоновые кислоты 60d677dc87dcd9320c87dd4e7b80d6ac
60d677dc87dcd9320c87dd4e7b80d6ac Коррозионные диаграммы
Коррозионные диаграммы 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Презентация на тему Угарный газ
Презентация на тему Угарный газ  Гидрофобная хроматография белков
Гидрофобная хроматография белков Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии История развития технологий термического крекинга в России и мире
История развития технологий термического крекинга в России и мире Серная кислота
Серная кислота Типы химической реакции
Типы химической реакции Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Железо и его соединения
Железо и его соединения Каучук
Каучук Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Презентация на тему Применение интерактивной доски на уроках химии
Презентация на тему Применение интерактивной доски на уроках химии  Основные химические понятия и законы химии. (Часть 2)
Основные химические понятия и законы химии. (Часть 2) X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Физические и химические свойства азота
Физические и химические свойства азота Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Реактор гидроочистки дизельного топлива
Реактор гидроочистки дизельного топлива