Содержание
- 2. Тема урока: ОКСИДЫ, ИХ КЛАССИФИКАЦИЯ. СВОЙСТВА ОКСИДОВ В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
- 3. Оксиды – сложные вещества Оксиды – бинарные соединения
- 4. Вода – жидкий оксид
- 5. Оксид кремния (IV) – твёрдый оксид
- 6. Углекислый и угарный газ – газообразные оксиды
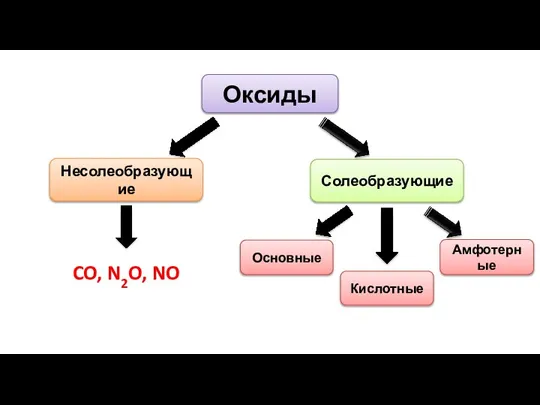
- 7. Оксиды Солеобразующие Несолеобразующие CO, N2O, NO Основные Амфотерные Кислотные
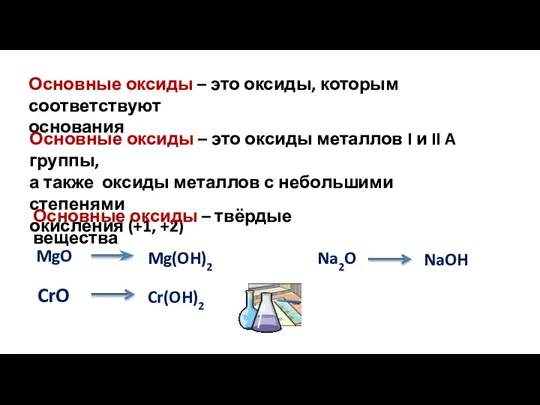
- 8. Основные оксиды – это оксиды, которым соответствуют основания Основные оксиды – это оксиды металлов I и
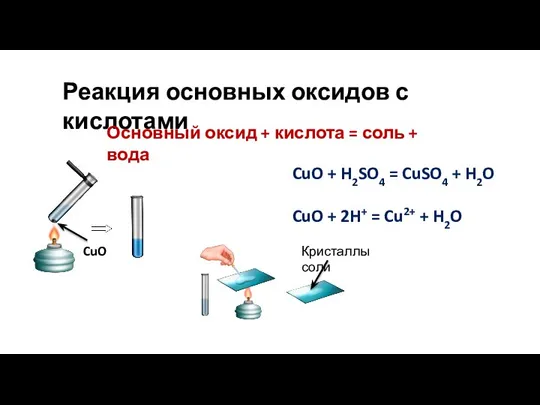
- 9. CuO + H2SO4 = CuSO4 + H2O CuO + 2H+ = Cu2+ + H2O Реакция основных
- 10. 3Na2O + P2O5 = 2Na3PO4 MgO + SO3 = MgSO4 CaO + CO2 = CaCO3 Реакция
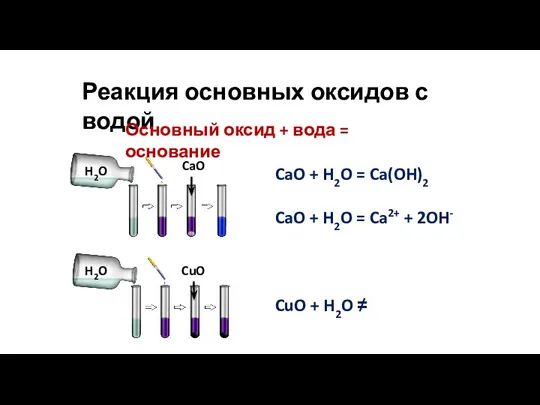
- 11. Реакция основных оксидов с водой CaO + H2O = Ca(OH)2 CaO + H2O = Ca2+ +
- 12. Кислотные оксиды – это оксиды, которым соответствуют кислоты Кислотные оксиды – это оксиды неметаллов и оксиды
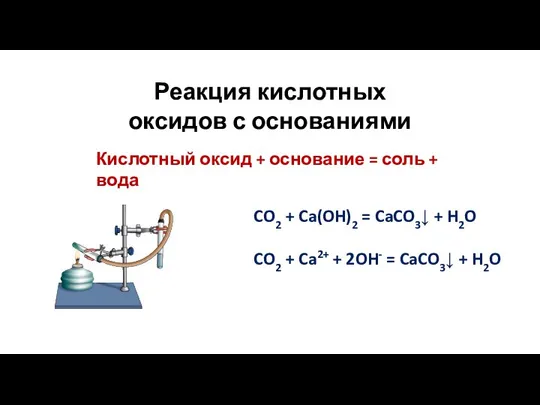
- 13. CO2 + Ca(OH)2 = CaCO3↓ + H2O CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
- 14. Реакция кислотных оксидов с основными Кислотный оксид + основный оксид = соль SO2 + K2O =
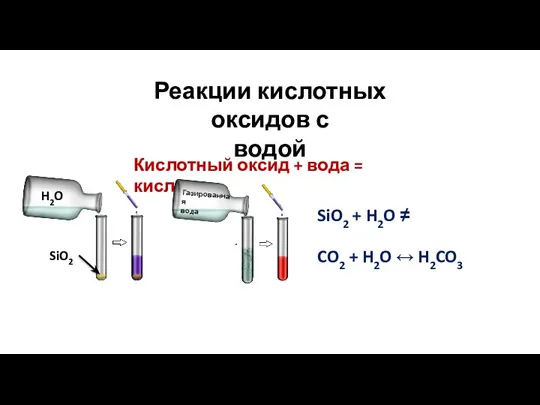
- 15. Реакции кислотных оксидов с водой Кислотный оксид + вода = кислота SiO2 + H2O ≠ CO2
- 17. Скачать презентацию







 Презентация на тему Хлор - физиологическая и патологическая роль в организме человека
Презентация на тему Хлор - физиологическая и патологическая роль в организме человека  Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Свойства аренов
Свойства аренов Что такое бинарные соединения?
Что такое бинарные соединения? Связь между основными классами неорганических соединений
Связь между основными классами неорганических соединений Кислотно-основное равновесие
Кислотно-основное равновесие Предмет химии. Вещества
Предмет химии. Вещества Пиримидин. Пиримидиновые основания
Пиримидин. Пиримидиновые основания Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Растворы электролитов (окончание)
Растворы электролитов (окончание) В1 витамині
В1 витамині Введение в практическую деятельность
Введение в практическую деятельность Водородная химическая связь
Водородная химическая связь Химические свойства воды
Химические свойства воды Жиры
Жиры Триады, октавы, спираль, таблица
Триады, октавы, спираль, таблица Контрольная работа
Контрольная работа Кислоты. Оксиды
Кислоты. Оксиды Алкадиены, каучуки
Алкадиены, каучуки Проведение лабраторных общеклинических исследований
Проведение лабраторных общеклинических исследований bc95487a97b0472591b20aef8d569081
bc95487a97b0472591b20aef8d569081 Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Галогенпроизводные углеводородов
Галогенпроизводные углеводородов Основания, их состав и название
Основания, их состав и название Классификация неорганических веществ
Классификация неорганических веществ