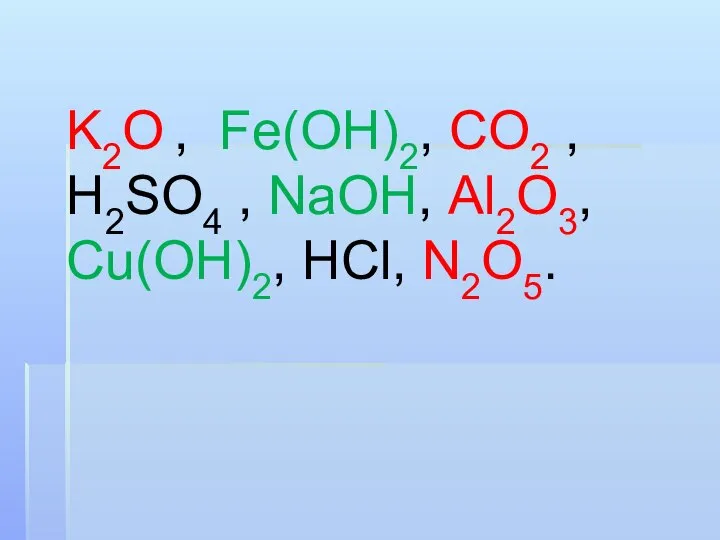
Слайд 2Выполните задания:
Из предложенного перечня веществ подчеркните отдельно формулы оксидов и оснований,

в соответствии с известной вам классификацией, и дайте им названия:
K2O , Fe(OH)2, CO2 , H2SO4 , NaOH, Al2O3, Cu(OH)2, HCl, N2O5.
Слайд 3K2O , Fe(OH)2, CO2 , H2SO4 , NaOH, Al2O3, Cu(OH)2, HCl, N2O5.
Слайд 5 ЗАДАЧИ УРОКА:
сформировать понятие о кислотах;
уяснить их состав, номенклатуру,
рассмотреть их классификацию

по разным признакам;
- узнать, как действуют индикаторы на кислоты;
- более подробно познакомиться с отдельными представителями кислот,
- узнать роль кислот в народном хозяйстве и в быту
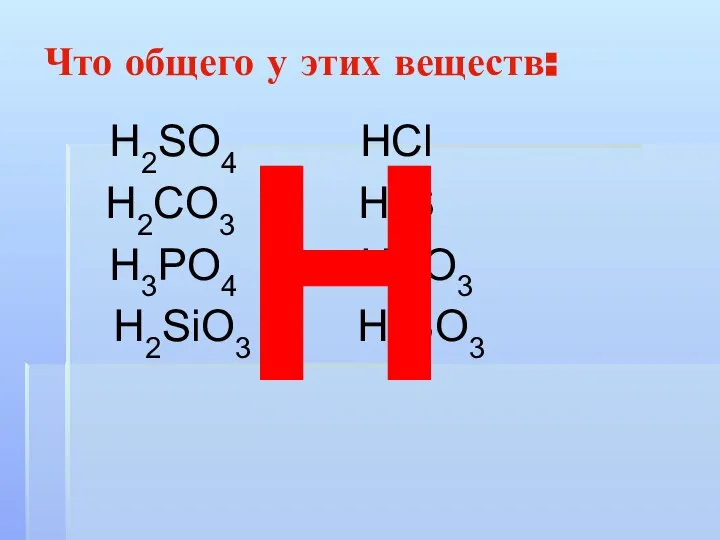
Слайд 6Что общего у этих веществ:
Н2SO4 НСl
Н2CO3 Н2S
Н3РO4 НNO3
Слайд 7Что такое кислоты?
Сложные вещества, молекулы которых состоят из атомов водорода и

кислотного остатка
Слайд 8Чем различаются эти кислоты
Н2SO4 НСl
Н2CO3 Н2S
Н3РO4 НNO3
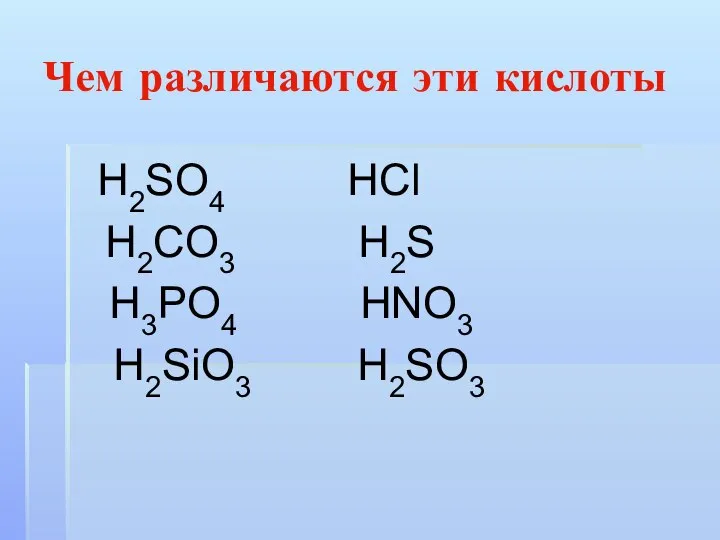
Н2SiO3 Н2SO3
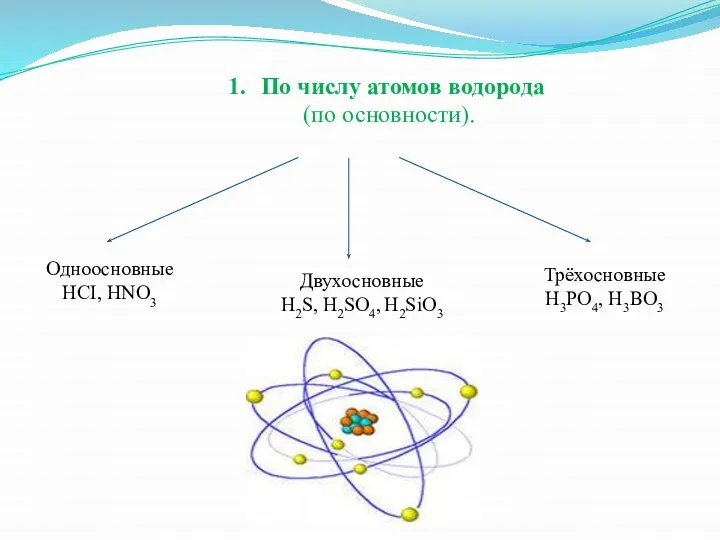
Слайд 9По числу атомов водорода
(по основности).
Одноосновные
HCI, HNO3
Трёхосновные
H3PO4, H3BO3
Двухосновные
H2S, H2SO4, H2SiO3
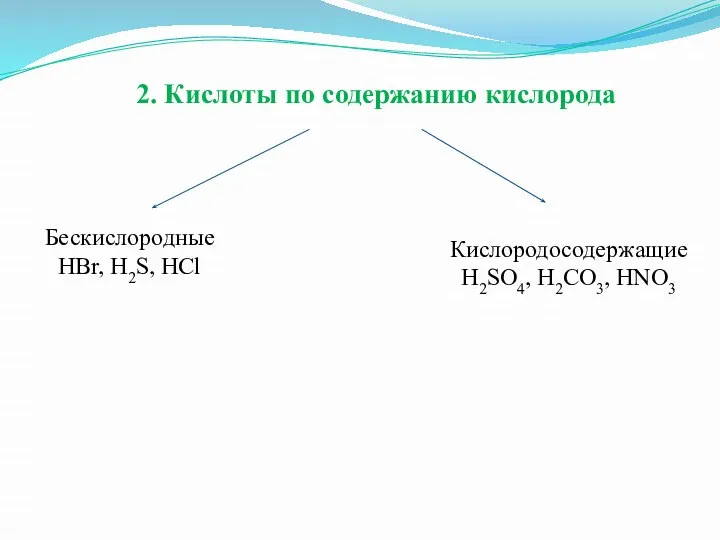
Слайд 102. Кислоты по содержанию кислорода
Бескислородные
HBr, H2S, HCl
Кислородосодержащие
H2SO4, H2CO3, HNO3
Слайд 113. Растворимость кислот.
Обратите внимание на таблицу растворимости кислот (в учебнике). Какой вывод

вы можете сделать? (Единственная нерастворимая кислота – кремниевая H2SO3)
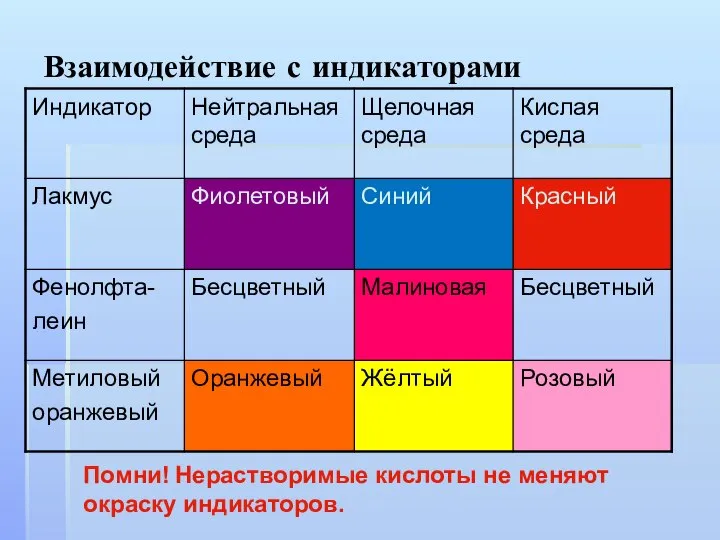
Слайд 12Взаимодействие с индикаторами
Помни! Нерастворимые кислоты не меняют окраску индикаторов.
Слайд 13Задание 1
Используя таблицу растворимости кислот, оснований и солей в воде, составьте

формулы разных кислот, дайте им названия, определите тип химической связи.
Н, Н2, Н3 , S, NО2, РО4, СI, SО3
Слайд 14Задание 2
«Третий лишний»:
В каждой строчке найти лишнюю формулу:
Н2S, Н2

SО4 , Н2SО3,
Н2СО3, Н3 РО4, Н2 SО4
Слайд 15Домашняя работа
1. П. 20, упр. №3, стр. 107
2. Задача №4,

стр.107
3. Задание по выбору:
- Подготовить сообщение :
1. «Кислотные дожди»
2. «Кислоты в природе и их применение в быту»
- Составить кроссворд по теме «Кислоты»














 Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Индиго-краситель
Индиго-краситель Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Классификация спиртов
Классификация спиртов Презентация на тему ИКТ на уроках химии
Презентация на тему ИКТ на уроках химии  Базовые масла и присадки
Базовые масла и присадки Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы
Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Disinfection without Chlorine and Chemistry
Disinfection without Chlorine and Chemistry Основания. 8 класс
Основания. 8 класс Сферы применения CaCO3
Сферы применения CaCO3 Алюминий. 9 класс
Алюминий. 9 класс Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Алкины
Алкины Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь 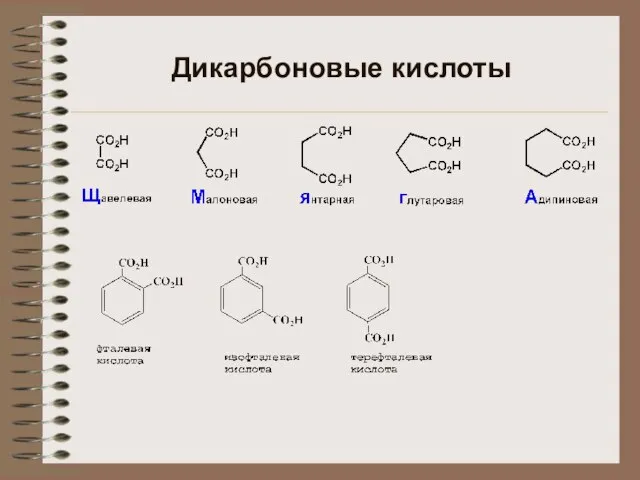 диовые кислоты
диовые кислоты Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Железо как химический элемент
Железо как химический элемент 1-методы количественного анализа
1-методы количественного анализа Карбоновые кислоты
Карбоновые кислоты Лавка возможностей
Лавка возможностей Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Калифорний Cf
Калифорний Cf Металлы d-элементы
Металлы d-элементы