Содержание
- 2. Аннотация Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по
- 3. Цели и задачи урока Образовательная обобщить и систематизировать знания обучающихся о классификации химических реакций отработать навыки
- 4. Содержание Аннотация Цели и задачи урока Типы химических реакций По числу вступивших в реакцию веществ По
- 5. Типы химических реакций По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению
- 6. По числу вступивших в реакцию веществ
- 7. Правило Бертолле В растворах электролитов реакции идут до конца в случае, если в результате образуется осадок,
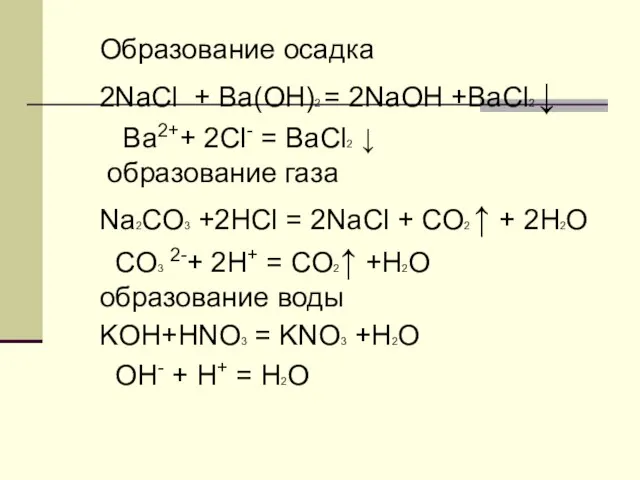
- 8. Образование осадка 2NaCl + Ba(OH)2 = 2NaOH +BaCl2 ↓ Ba2++ 2Cl- = BaCl2 ↓ образование газа
- 9. По тепловому эффекту Экзотермические - идут с выделение теплоты S + O2 = SO2 + Q
- 10. По обратимости Необратимые - идут только в одном направлении Условия: образование осадка или слабого электролита (Н2О),
- 11. По изменению степени окисления Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 Окислительно
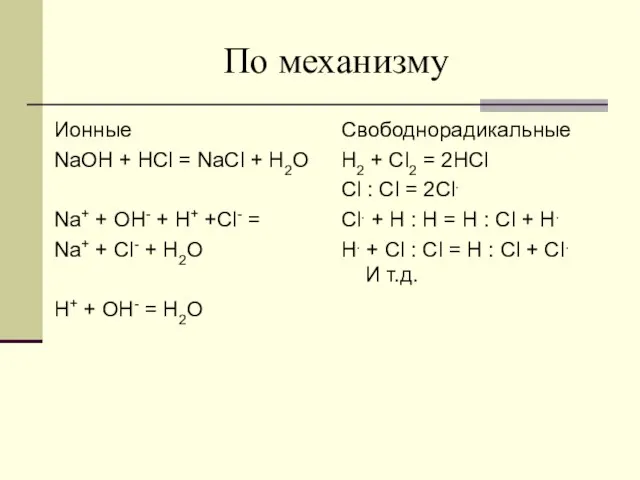
- 12. По механизму Ионные NaOH + HCl = NaCl + H2O Na+ + OH- + H+ +Cl-
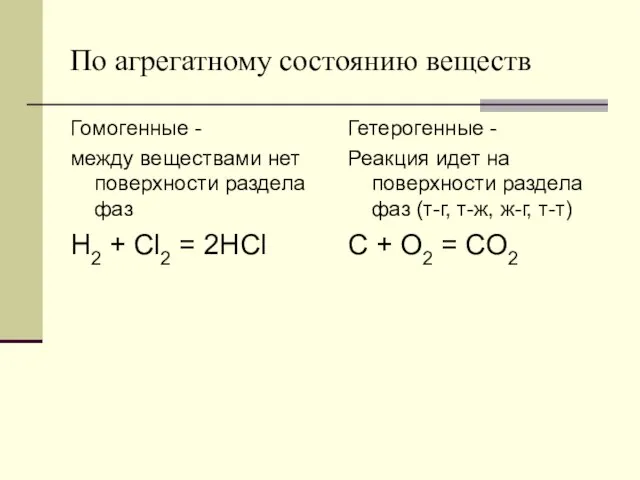
- 13. По агрегатному состоянию веществ Гомогенные - между веществами нет поверхности раздела фаз H2 + Cl2 =
- 14. Проверь себя Перепиши схемы химических реакций в тетрадь, расставьте коэффициенты. Mn(OH)2? MnO + H2O -Q FeSO4
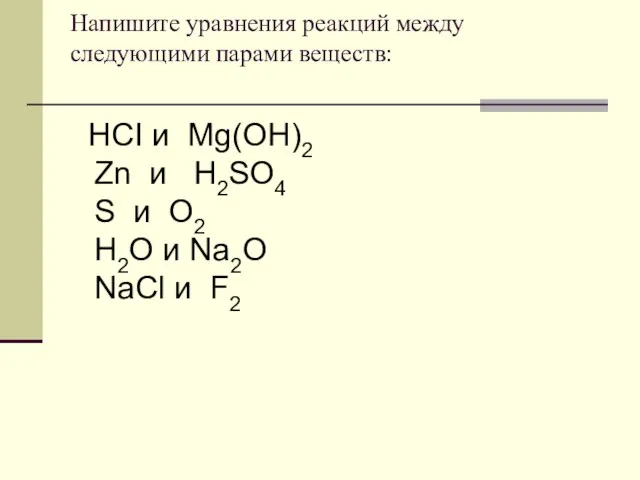
- 15. Напишите уравнения реакций между следующими парами веществ: HCI и Mg(OH)2 Zn и H2SO4 S и O2
- 16. Вывод Поставленные цели урока достигнуты
- 18. Скачать презентацию











 Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Химия вокруг нас
Химия вокруг нас Виды автомобильного топлива
Виды автомобильного топлива Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Многоядерные Арены
Многоядерные Арены Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Презентация на тему Выдающиеся русские ученые химики
Презентация на тему Выдающиеся русские ученые химики  Применение одноатомных и многоатомных спиртов
Применение одноатомных и многоатомных спиртов Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар 14257fc50bc406ef33f49ad14aa3f48b
14257fc50bc406ef33f49ad14aa3f48b Мило. Вищі карбонові кислоти
Мило. Вищі карбонові кислоти Углеводороды. Урок-игра
Углеводороды. Урок-игра Ароматические углеводороды
Ароматические углеводороды Основные понятия химии
Основные понятия химии Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации) Презентация на тему Соединения серы
Презентация на тему Соединения серы  Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Классификация ненасыщенных углеводородов
Классификация ненасыщенных углеводородов Природные кристаллы
Природные кристаллы Строение атома
Строение атома Дизельное топливо
Дизельное топливо Этиленгликоль
Этиленгликоль Свойства растворов и их взаимодействие с газовой фазой
Свойства растворов и их взаимодействие с газовой фазой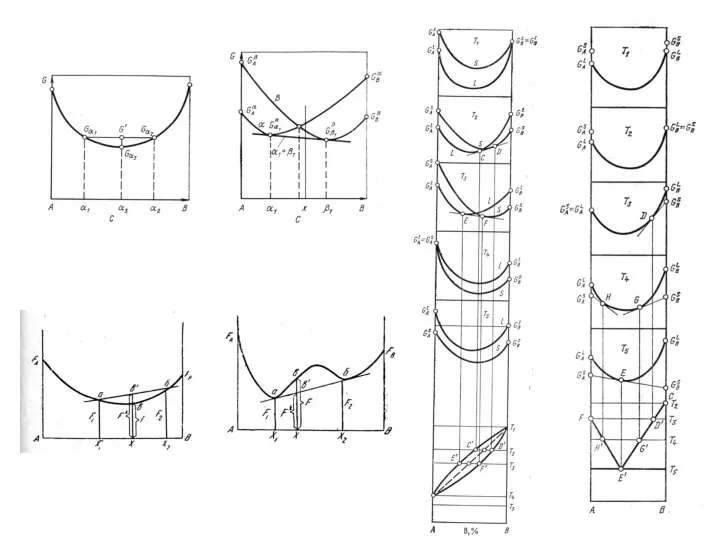 Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Металлы и их соединения
Металлы и их соединения Химические свойства алканов. Алканы
Химические свойства алканов. Алканы