Содержание
- 2. Сформировать понятие о кислотах как классе электролитов. Рассмотреть их классификацию и общие свойства в свете ионных
- 3. « Едва ли найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как H2 SO4.
- 4. Кислоты электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков. HCL = H++CL- H3РO4
- 5. Физические свойства кислот Жидкости H2SO4 HNO3 и др. Твердые H3PO4 H2SiO3, борная и многие органические, например
- 6. Классификация кислот КИСЛОТЫ КИСЛОРОДНЫЕ H2SO4, HNO3 БЕСКИСЛОРОДНЫЕ HCL, HBr ОДНООСНОВНЫЕ HCL, HNO3 ДВУХОСНОВНЫЕ H2SO4, H2S ТРЕХОСНОВНЫЕ
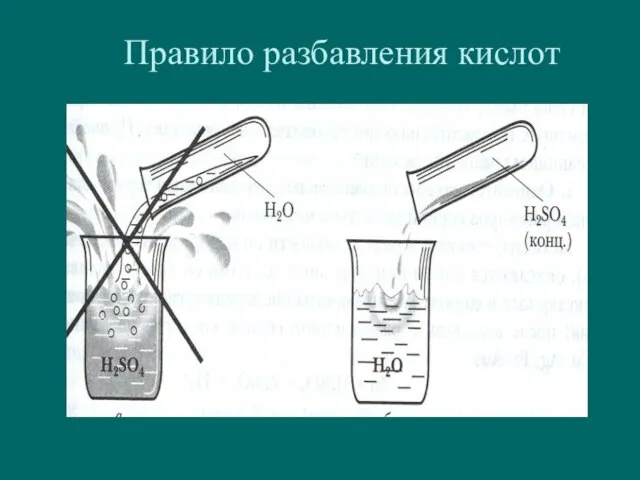
- 7. Правило разбавления кислот
- 8. Кислоты изменяют окраску индикатора
- 9. Химические свойства кислот Кислота + основание = соль + вода (реакция нейтрализации) H2SO4 +2 NaOH =
- 10. Кислота + оксид металла = соль + вода CuO + H2SO4 = CuSO4 + H2O CuO+
- 11. Кислота + металл = соль + водород 2HCL +Zn = ZnCL2 + H2 2H+ + Zn0
- 12. Кислота + соль = новая кислота + новая соль Условия: - в результате реакции должны получиться
- 13. 1.Формула кислоты это: а) NaOH в) CuCL2 б) HCL г) SO3 2. Лакмус в растворе, полученном
- 15. Скачать презентацию











 Физическая и коллоидная химия
Физическая и коллоидная химия Электролитическая диссоциация
Электролитическая диссоциация Классификация реакций. Таблица
Классификация реакций. Таблица Неорганическая и органическая химия
Неорганическая и органическая химия Презентация на тему Теория электролитической диссоциации 8 класс
Презентация на тему Теория электролитической диссоциации 8 класс  Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Реакции ионного обмена
Реакции ионного обмена Метионин
Метионин Химические средства защиты растений
Химические средства защиты растений Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Формула любви
Формула любви Презентация на тему В мире полимеров
Презентация на тему В мире полимеров  Органические полимеры
Органические полимеры Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Природные источники углеводородов
Природные источники углеводородов Обобщение и подготовка к химии 8 класс
Обобщение и подготовка к химии 8 класс Соединения галогенов
Соединения галогенов Уксусная кислота
Уксусная кислота Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Путешествие по морю
Путешествие по морю Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4
Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4 Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакции в органической химии
Реакции в органической химии Презентация на тему Катализ
Презентация на тему Катализ